Calciumbicarbonat (Ca(HCO3)2) ist eine Verbindung, die Kalzium, Kohlenstoff und Sauerstoff enthält. Es kommt häufig in Mineralwasser vor und ist wichtig für die Knochengesundheit und Muskelfunktion.
| IUPAC-Name | Calciumhydrogencarbonat |
| Molekularformel | Ca(HCO3)2 |
| CAS-Nummer | 3983-19-5 |
| Synonyme | Calciumhydrogencarbonat, Calciumhydrogencarbonat, hydratisiertes Calciumbicarbonat, hydratisiertes Calciumhydrogencarbonat, EINECS 223-070-3 |
| InChI | InChI=1S/C2H2O3.Ca/c3-1(4)2(5)6;/h(H2,3,4)(H,5,6);/q;+2/p-2 |
Eigenschaften von Calciumbicarbonat
Calciumbicarbonat-Formel
Die chemische Formel für Calciumbicarbonat lautet Ca(HCO3)2. Dies weist darauf hin, dass die Verbindung aus einem Ca2+-Ion und zwei HCO3–Ionen besteht. Die Formel ist wichtig für das Verständnis der Zusammensetzung der Verbindung und ihrer chemischen Eigenschaften. Ca(HCO3)2 kann durch Auflösen von Calciumcarbonat in kohlensäurehaltigem Wasser oder durch Reaktion von Calciumhydroxid mit Kohlendioxid gebildet werden.
Molmasse von Calciumbicarbonat
Die Molmasse von Ca(HCO3)2 beträgt 162,114 g/mol. Dies wird berechnet, indem die Atommassen jedes Elements in der Verbindung addiert werden. Ca(HCO3)2 enthält Calcium-, Wasserstoff-, Kohlenstoff- und Sauerstoffatome, und die Molmasse spiegelt die Gesamtmasse aller dieser Atome wider. Die Kenntnis der Molmasse ist wichtig, um die Menge an Ca(HCO3)2 zu bestimmen, die für chemische Reaktionen benötigt wird, oder um die Konzentration einer Lösung zu bestimmen.
Siedepunkt von Calciumbicarbonat
Ca(HCO3)2 zersetzt sich, bevor es seinen Siedepunkt erreicht. Bei normalem Atmosphärendruck zerfällt Ca(HCO3)2 bei Temperaturen über 50°C in Calciumcarbonat, Wasser und Kohlendioxid. Es hat daher keinen Siedepunkt.
Schmelzpunkt von Calciumbicarbonat
Ca(HCO3)2 hat keinen eindeutigen Schmelzpunkt, da es sich zersetzt, bevor es seinen Schmelzpunkt erreicht. Bei Temperaturen über 50 °C zerfällt es in Calciumcarbonat, Wasser und Kohlendioxid. Allerdings kann durch thermische Zersetzung von Ca(HCO3)2 Calciumoxid erzeugt werden, das einen hohen Schmelzpunkt von 2613 °C hat.
Dichte von Calciumbicarbonat g/ml
Die Dichte von Ca(HCO3)2 beträgt 2,21 g/ml. Das bedeutet, dass ein Kubikzentimeter Ca(HCO3)2 2,21 Gramm wiegt. Die Dichte von Ca(HCO3)2 ist geringer als die Dichte von Calciumcarbonat, die 2,71 g/ml beträgt. Die Dichte eines Stoffes ist wichtig für die Bestimmung der Masse eines Stoffes pro Volumeneinheit und kann zur Berechnung der Konzentration einer Lösung verwendet werden.
Molekulargewicht von Calciumbicarbonat
Das Molekulargewicht von Ca(HCO3)2 beträgt 162,114 g/mol. Dieser Wert wird durch Addition der Atomgewichte von Calcium, Wasserstoff, Kohlenstoff und Sauerstoff in der Verbindung berechnet. Das Molekulargewicht ist wichtig für die Bestimmung der Menge an Ca(HCO3)2, die für chemische Reaktionen benötigt wird, und für die Bestimmung der Konzentration einer Lösung.
Struktur von Calciumbicarbonat
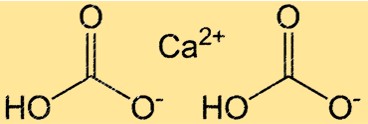
Ca(HCO3)2 hat aufgrund des Vorhandenseins ionischer und kovalenter Bindungen eine komplexe Struktur. Die Verbindung besteht aus einem Ca2+-Ion und zwei HCO3–Ionen, die durch Ionenbindungen zusammengehalten werden. Das HCO3-Ion selbst ist ein mehratomiges Ion, bestehend aus einem Kohlenstoffatom, zwei Sauerstoffatomen und einem Wasserstoffatom. Das Kohlenstoffatom ist an ein Sauerstoffatom doppelt und an das andere einfach gebunden, und das Wasserstoffatom ist an eines der Sauerstoffatome gebunden. Die Struktur von Ca(HCO3)2 ist wichtig für das Verständnis seiner Reaktivität und Löslichkeit in Wasser.
| Aussehen | weißes Puder |
| Spezifisches Gewicht | 2,21 g/cm³ |
| Farbe | Farblos |
| Geruch | Geruchlos |
| Molmasse | 162.114 g/Mol |
| Dichte | 2,21 g/ml |
| Fusionspunkt | Zersetzt sich oberhalb von 50°C |
| Siedepunkt | Zersetzt sich oberhalb von 50°C |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Löslich |
| Löslichkeit | Löslich in Wasser, unlöslich in Alkohol |
| Dampfdruck | Unerheblich |
| Wasserdampfdichte | Unzutreffend |
| pKa | 6.4 – 10.3 |
| pH-Wert | 8.2 – 8.4 |
Sicherheit und Gefahren von Calciumbicarbonat
Ca(HCO3)2 wird von den Aufsichtsbehörden im Allgemeinen als sicher für die Verwendung in Lebensmitteln und Getränken angesehen. Das Einatmen von Ca(HCO3)2-Staub kann jedoch zu Reizungen der Atemwege führen. Kontakt mit den Augen kann zu Hornhautreizungen oder -schäden führen. Die Einnahme großer Mengen Ca(HCO3)2 kann zu Magen-Darm-Reizungen führen. Der Umgang mit Ca(HCO3)2 kann bei empfindlichen Personen auch zu Hautreizungen oder Dermatitis führen. Bei der Arbeit mit Ca(HCO3)2 ist es wichtig, die richtigen Handhabungsverfahren einzuhalten, beispielsweise das Tragen von Handschuhen und Schutzbrillen. Darüber hinaus ist es wichtig, Ca(HCO3)2 an einem kühlen, trockenen Ort und fern von unverträglichen Substanzen aufzubewahren.
| Gefahrensymbole | Keiner |
| Sicherheitsbeschreibung | Ungiftig und sicher |
| UN-Identifikationsnummern | N / A |
| HS-Code | 2836.50.00 |
| Gefahrenklasse | Nicht gefährlich |
| Verpackungsgruppe | N / A |
| Toxizität | Ungiftig und sicher |
Methoden zur Synthese von Calciumbicarbonat
Durch die Reaktion von Calciumcarbonat (CaCO3) mit Kohlendioxid (CO2) und Wasser (H2O) entsteht Ca(HCO3)2. Diese Reaktion kann auf natürliche Weise in bestimmten Gewässern auftreten, in denen Kohlendioxid und Kalziumkarbonat vorhanden sind.
Zur Herstellung von Ca(HCO3)2 kann Kohlendioxid durch eine Lösung von Calciumhydroxid (Ca(OH)2) geleitet werden. Bei dieser Reaktion entsteht Calciumcarbonat , das dann mit überschüssigem Kohlendioxid zu Ca(HCO3)2 reagiert.
Eine weitere Methode zur Synthese von Ca(HCO3)2 beinhaltet die Reaktion von Calciumchlorid (CaCl2) mit Natriumbicarbonat (NaHCO3). Bei dieser Reaktion entstehen Ca(HCO3)2 sowie Natriumchlorid (NaCl) und Kohlendioxid.
Es ist wichtig zu beachten, dass Ca(HCO3)2 eine relativ instabile Verbindung ist und in Gegenwart von Hitze oder sauren Bedingungen zu Calciumcarbonat und Kohlendioxid zerfällt. Um eine Zersetzung zu vermeiden, muss Ca(HCO3)2 vorsichtig gehandhabt und gelagert werden.
Verwendung von Calciumbicarbonat
Hier sind einige häufige Verwendungen von Ca(HCO3)2:
- Lebensmittel und Getränke: Wird als Lebensmittelzusatzstoff bei der Herstellung bestimmter Backwaren, Backwaren und Erfrischungsgetränke verwendet.
- Wasseraufbereitung: Wird verwendet, um die Alkalität des Wassers zu erhöhen, was dazu beiträgt, Rohrkorrosion zu verhindern und den Säuregehalt saurer Wasserquellen zu reduzieren.
- Landwirtschaft: Wird als Bodenverbesserungsmittel verwendet, um den Kalziumgehalt des Bodens zu erhöhen, was die Bodenstruktur und das Pflanzenwachstum verbessern kann.
- Pharmazeutika: Wird in einigen Antazid-Formulierungen als neutralisierendes Mittel zur Linderung von Sodbrennen und Verdauungsstörungen verwendet.
- Bauwesen: Wird als Kalziumquelle bei der Herstellung bestimmter Baumaterialien wie Zement und Gips verwendet.
- Reinigung: Wird als mildes Scheuermittel in einigen Reinigungsprodukten wie Zahnpasta und Reinigungspulvern verwendet.
- Kosmetika: Wird in einigen kosmetischen Formulierungen als Puffermittel verwendet, um den pH-Wert des Produkts aufrechtzuerhalten.
Fragen:
F: Was ist Calciumbicarbonat?
A: Ca(HCO3)2 ist ein weißes kristallines Pulver, das entsteht, wenn Calciumcarbonat mit Kohlendioxid und Wasser reagiert.
F: Welche drei Substanzen müssen interagieren, um Calciumbicarbonat zu bilden?
A: Calciumcarbonat, Kohlendioxid und Wasser müssen interagieren, um Ca(HCO3)2 zu bilden.
F: Ist Calciumbicarbonat ein Treibmittel?
A: Ja, Ca(HCO3)2 kann als Backmittel beim Backen verwendet werden, um das Aufgehen des Teigs zu unterstützen.
F: Lösen sich Kalziumbikarbonat-Ohrkristalle jemals auf?
A: Ja, Ca(HCO3)2-Kristalle in der Ohrmuschel können sich von selbst oder unter Behandlung auflösen, beispielsweise durch die Verwendung bestimmter Medikamente oder Manöver.
F: Wie groß ist die Gesamtzahl der Atommole in einem Mol Ca(HCO3)2?
A: Ein Mol Ca(HCO3)2 enthält 10 Mol Atome.
F: Wie viele Atome gibt es in Ca(HCO3)2?
A: In Ca(HCO3)2 sind insgesamt 18 Atome vorhanden, darunter 1 Calciumatom, 2 Kohlenstoffatome, 6 Wasserstoffatome und 9 Sauerstoffatome.
F: Was ist Ca(HCO3)2?
A: Ca(HCO3)2 ist die chemische Formel für Calciumbicarbonat, eine Verbindung, die entsteht, wenn Calciumcarbonat mit Kohlendioxid und Wasser reagiert.
