Calciumacetat (Ca(C2H3O2)2) ist eine Verbindung aus Calcium und Essigsäure. Es wird häufig als Medikament zur Senkung des Phosphatspiegels bei Menschen mit Nierenerkrankungen eingesetzt.
| IUPAC-Name | Calciumacetat |
| Molekularformel | Ca(C2H3O2)2 |
| CAS-Nummer | 62-54-4 |
| Synonyme | Essigsäure, Calciumsalz; Calciumacetat (Französisch); Calciumdiacetat; Calciumethanoat; E263 |
| InChI | InChI=1S/2C2H4O2.Ca/c2 1-2(3)4;/h2 1H3,(H,3,4);/q;;+2/p-2 |
Eigenschaften von Calciumacetat
Calciumacetat-Formel
Die Formel für Calciumacetat lautet Ca(C2H3O2)2. Diese Formel gibt an, dass ein Mol Calciumacetat ein Mol Calciumionen (Ca2+) und zwei Mol Acetationen (C2H3O2-) enthält. Die Formel für Calciumacetat ist wichtig für die Bestimmung der Stöchiometrie chemischer Reaktionen, an denen diese Verbindung beteiligt ist.
Molmasse von Calciumacetat
Die Molmasse von Ca(C2H3O2)2 beträgt 158,17 g/mol. Dieser Wert stellt die Masse eines Mols Ca(C2H3O2)2 dar, was seinem Molekulargewicht entspricht. Die Molmasse ist ein entscheidender Parameter bei der Bestimmung der Stöchiometrie chemischer Reaktionen mit Ca(C2H3O2)2. Dieser Wert wird berechnet, indem die Atommassen aller in einem Mol Ca(C2H3O2)2 vorhandenen Atome addiert werden.
Siedepunkt von Calciumacetat
Der Siedepunkt von Ca(C2H3O2)2 beträgt 160°C (320°F). Dieser Wert gibt die Temperatur an, bei der Ca(C2H3O2)2 seinen Zustand von flüssig in gasförmig ändert. Der Siedepunkt von Ca(C2H3O2)2 ist deutlich höher als der von Wasser, das bei 100 °C (212 °F) siedet. Dieser hohe Siedepunkt ist auf die ionische Natur von Ca(C2H3O2)2 und seine starken intermolekularen Kräfte zurückzuführen.
Schmelzpunkt von Calciumacetat
Der Schmelzpunkt von Ca(C2H3O2)2 beträgt 160–170 °C (320–338 °F). Dieser Wert gibt die Temperatur an, bei der Ca(C2H3O2)2 seinen Zustand vom festen in den flüssigen Zustand ändert. Der Schmelzpunkt von Ca(C2H3O2)2 ist etwas höher als der von Wasser, das bei 0 °C (32 °F) schmilzt. Der hohe Schmelzpunkt von Ca(C2H3O2)2 ist auf die ionische Natur der Verbindung und ihre starken intermolekularen Kräfte zurückzuführen.
Dichte von Calciumacetat g/ml
Die Dichte von Ca(C2H3O2)2 beträgt 1,5 g/ml. Dieser Wert gibt die Masse von Ca(C2H3O2)2 an, die in einem Milliliter seiner Lösung vorhanden ist. Die Dichte von Ca(C2H3O2)2 ist größer als die von Wasser, das eine Dichte von 1 g/ml hat. Die hohe Dichte von Ca(C2H3O2)2 ist auf seine ionische Natur und das Vorhandensein von Calciumionen in der Verbindung zurückzuführen.
Molekulargewicht von Calciumacetat
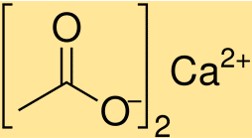
Das Molekulargewicht von Ca(C2H3O2)2 beträgt 158,17 g/mol. Dieser Wert stellt die Summe der Atomgewichte aller in einem Ca(C2H3O2)2-Molekül vorhandenen Atome dar. Das Molekulargewicht ist ein entscheidender Parameter bei der Bestimmung der Eigenschaften von Ca(C2H3O2)2 und seines Verhaltens bei chemischen Reaktionen.
Struktur von Calciumacetat
Die Struktur von Ca(C2H3O2)2 ist eine ionische Verbindung, in der die Ca2+-Ionen von zwei C2H3O2–Ionen umgeben sind. C2H3O2–Ionen fungieren als zweizähnige Liganden und bilden Koordinationsbindungen mit Ca2+-Ionen. Die Struktur von Ca(C2H3O2)2 ist kristallin und hat eine kubische Form.
| Aussehen | weißes kristallines Pulver |
| Spezifisches Gewicht | 1,5 g/ml |
| Farbe | Weiß |
| Geruch | Geruchlos |
| Molmasse | 158,17 g/Mol |
| Dichte | 1,5 g/ml |
| Fusionspunkt | 160–170 °C (320–338 °F) |
| Siedepunkt | 160 °C (320 °F) |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Löslich |
| Löslichkeit | Löslich in Wasser, Ethanol und Aceton |
| Dampfdruck | Unzutreffend |
| Wasserdampfdichte | Unzutreffend |
| pKa | 9.24 |
| pH-Wert | 7-8 (5%ige Lösung) |
Sicherheit und Gefahren von Calciumacetat
Ca(C2H3O2)2 gilt im Allgemeinen als sicher, wenn es bestimmungsgemäß verwendet wird. Allerdings kann die Einwirkung großer Mengen Ca(C2H3O2)2 zu Reizungen der Haut, Augen und Atemwege führen. Die Einnahme großer Mengen Ca(C2H3O2)2 kann zu Magenbeschwerden, Erbrechen und Durchfall führen. Es ist wichtig, vorsichtig mit Ca(C2H3O2)2 umzugehen und das Einatmen oder Verschlucken des Stoffes zu vermeiden. Ca(C2H3O2)2 kann auch eine Gefahr für die Umwelt, insbesondere für Wasserlebewesen, darstellen und muss ordnungsgemäß entsorgt werden. Wie bei allen Chemikalien ist es wichtig, beim Umgang mit Ca(C2H3O2)2 die Sicherheitshinweise auf dem Etikett zu lesen und zu befolgen und geeignete Schutzausrüstung zu verwenden.
| Gefahrensymbole | Keiner |
| Sicherheitsbeschreibung | Einatmen, Verschlucken und Kontakt mit Haut und Augen vermeiden. In einem gut belüfteten Bereich verwenden und geeignete Schutzausrüstung tragen. |
| UN-Identifikationsnummern | Unzutreffend |
| HS-Code | 291529 |
| Gefahrenklasse | Gemäß OSHA Hazard Communication (29 CFR 1910.1200) nicht als gefährlich eingestuft. |
| Verpackungsgruppe | Unzutreffend |
| Toxizität | Geringe Toxizität. Kann Haut- und Augenreizungen verursachen. Die Einnahme großer Mengen kann zu Magen-Darm-Beschwerden führen. |
Methoden zur Synthese von Calciumacetat
Zur Synthese von Ca(C2H3O2)2 können verschiedene Methoden eingesetzt werden.
Eine übliche Methode beinhaltet die Reaktion von Calciumcarbonat mit Essigsäure. Geben Sie das Calciumcarbonat zu einer Essigsäurelösung und erhitzen Sie die Mischung zum Rückfluss. Filtrieren Sie die Mischung und lassen Sie das Filtrat abkühlen und kristallisieren, um Ca(C2H3O2)2 zu bilden.
Eine andere Methode beinhaltet die Reaktion von Calciumhydroxid mit Essigsäure . Calciumhydroxid zur Essigsäurelösung hinzufügen. Rühren und erhitzen Sie die Mischung, um eine klare Lösung zu erhalten. Filtrieren Sie die Lösung und lassen Sie das Filtrat abkühlen und kristallisieren, um Ca(C2H3O2)2 zu bilden.
Eine andere Methode beinhaltet die Reaktion von Calciumoxid mit Essigsäure . Calciumoxid zur Essigsäurelösung hinzufügen. Rühren und erhitzen Sie die Mischung, um eine klare Lösung zu erhalten. Filtrieren Sie die Lösung und lassen Sie das Filtrat abkühlen und kristallisieren, um Ca(C2H3O2)2 zu bilden.
Die Wahl der Synthesemethode kann von Faktoren wie der gewünschten Ausbeute und Reinheit des Produkts sowie der spezifischen Anwendung, für die das Ca(C2H3O2)2 verwendet wird, abhängen.
Verwendung von Calciumacetat
Ca(C2H3O2)2 hat mehrere Anwendungen in verschiedenen Bereichen. Hier sind einige häufige Verwendungen von Ca(C2H3O2)2:
- Lebensmittelzusatzstoff: Wird als Lebensmittelzusatzstoff, insbesondere in Backwaren, verwendet, um die Textur zu verbessern und die Haltbarkeit zu verlängern.
- Medizinische Anwendungen: Wird als Arzneimittel zur Behandlung hoher Phosphatwerte im Blut bei Patienten mit chronischer Nierenerkrankung verwendet. Es wirkt, indem es sich an in der Nahrung enthaltenes Phosphat bindet und dessen Aufnahme durch den Körper verhindert.
- Wasseraufbereitung: Wird bei der Wasseraufbereitung verwendet, um den Gehalt an Blei und anderen Schwermetallen zu reduzieren.
- Laborreagenz: Wird in Laboratorien als Reagenz für verschiedene chemische Reaktionen verwendet.
- Antimykotisches Mittel: Wird auch als Antimykotikum bei der Behandlung bestimmter Hautinfektionen verwendet.
- Betonbeschleuniger: Wird als Betonbeschleuniger verwendet, der den Abbindeprozess des Betons beschleunigt.
- Flammhemmend: Wird als Flammschutzmittel in verschiedenen Materialien, einschließlich Kunststoffen und Textilien, verwendet.
Fragen:
F: Ist Calciumacetat sauer, basisch oder neutral?
A: Ca(C2H3O2)2 ist eine basische Verbindung.
F: Ist Calciumacetat wasserlöslich?
A: Ja, Ca(C2H3O2)2 ist wasserlöslich.
F: Wie stellt man Calciumacetat her?
A: Ca(C2H3O2)2 kann durch verschiedene Methoden hergestellt werden, einschließlich der Reaktion von Calciumcarbonat oder Calciumhydroxid mit Essigsäure. Die resultierende Mischung wird dann filtriert und man lässt das Filtrat abkühlen und kristallisieren, wodurch Ca(C2H3O2)2 entsteht.
F: Wo kann man Calciumacetat kaufen?
A: Ca(C2H3O2)2 kann bei Chemikalienlieferanten, Laborfachgeschäften und Online-Händlern erworben werden.
F: Ist Calciumacetat ionisch oder kovalent?
A: Ca(C2H3O2)2 ist eine ionische Verbindung, die aus Calciumkationen und Acetanionen besteht, die durch ionische Bindungen zusammengehalten werden.
