Benzol oder C6H6 ist eine farblose, leicht entzündliche Flüssigkeit mit süßem Geruch. Es wird bei der Herstellung von Kunststoffen, synthetischen Fasern, Gummi, Pestiziden und anderen Chemikalien verwendet. Es gilt als krebserregend und kann gesundheitliche Probleme verursachen.
| Name der IUPAC | Benzol |
| Molekularformel | C6H6 |
| CAS-Nummer | 71-43-2 |
| Synonyme | Benzol, Phen, Annulen, Cyclohexatrien usw. |
| InChI | InChI=1S/C6H6/c1-2-4-6-5-3-1/h1-6H |
Eigenschaften von Benzol
Molmasse von Benzol
Benzol hat eine Molmasse von 78,11 g/mol. Es ist eine zyklische organische Verbindung, die aus sechs Kohlenstoffatomen und sechs Wasserstoffatomen besteht. Die Molmasse von Benzol wird durch Addition der Atommassen seiner Atombestandteile berechnet, die für Kohlenstoff 12,01 g/mol und für Wasserstoff 1,01 g/mol betragen. Benzol wird in der chemischen Industrie häufig als Rohstoff für die Herstellung vieler wichtiger Verbindungen verwendet. Die Molmasse von Benzol ist wichtig für die Bestimmung der Menge der Verbindung, die für Reaktionen und andere Anwendungen benötigt wird.
Benzolformel
Benzol hat die chemische Formel C6H6. Diese Formel gibt die Anzahl und Art der im Molekül vorhandenen Atome an. Die Formel von Benzol ist wichtig für die Bestimmung seiner physikalischen und chemischen Eigenschaften sowie seiner Reaktivität bei chemischen Reaktionen. Die Benzolformel wird auch zur Benennung und Identifizierung der Verbindung in verschiedenen Zusammenhängen verwendet, beispielsweise in der chemischen Literatur und in regulatorischen Dokumenten.
Siedepunkt von Benzol
Benzol hat einen Siedepunkt von 80,1 °C oder 176,2 °F. Dies ist im Vergleich zu anderen organischen Verbindungen mit ähnlichem Molekulargewicht relativ gering. Der Siedepunkt von C6H6 beruht auf seinen intermolekularen Anziehungskräften, insbesondere den Van-der-Waals-Kräften. Mit zunehmender Temperatur nimmt auch die kinetische Energie der Moleküle zu, was letztendlich zum Abbau dieser zwischenmolekularen Kräfte und zum Übergang von der flüssigen in die Gasphase führt. Der niedrige Siedepunkt von C6H6 macht es nützlich für Anwendungen, bei denen es notwendig ist, die Verbindung durch Verdampfen zu entfernen.
Schmelzpunkt von Benzol
C6H6 hat einen Schmelzpunkt von 5,5 °C oder 41,9 °F. Dies ist im Vergleich zu anderen aromatischen Verbindungen mit ähnlichem Molekulargewicht relativ gering. Der Schmelzpunkt von C6H6 ist auf seine Molekülstruktur zurückzuführen, die aus einem planaren Ring aus Kohlenstoffatomen mit alternierenden Doppelbindungen besteht. Die Anordnung der Elektronen im Ring verleiht C6H6 seine charakteristische Stabilität und macht es resistent gegen viele chemische Reaktionen. Der niedrige Schmelzpunkt von C6H6 macht es nützlich für Anwendungen, bei denen es notwendig ist, die Verbindung für die weitere Verarbeitung zu schmelzen.
Benzoldichte g/ml
Benzol hat bei Raumtemperatur (25 °C oder 77 °F) eine Dichte von 0,879 g/ml. Die Benzoldichte ist ein Maß für die Masse pro Volumeneinheit der Verbindung. Die geringe Dichte von Benzol macht es für Anwendungen nützlich, bei denen ein Lösungsmittel mit geringer Dichte erforderlich ist, beispielsweise bei der Trennung von Verbindungen anhand ihrer Dichte.
Molekulargewicht von Benzol
Benzol hat ein Molekulargewicht von 78,11 g/mol. Das Molekulargewicht von Benzol ist die Summe der Atomgewichte seiner Atombestandteile. Das Molekulargewicht von Benzol ist wichtig für die Bestimmung der Stöchiometrie von Reaktionen und für die Bestimmung der Benzolkonzentration in Lösungen.
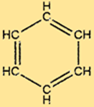
Struktur von Benzol
C6H6 hat eine einzigartige Struktur, die aus einem hexagonalen Ring von Kohlenstoffatomen besteht, die jeweils an zwei andere Kohlenstoffatome und ein Wasserstoffatom gebunden sind. Alternierende Doppelbindungen im Ring verleihen C6H6 seine charakteristische Stabilität und machen es resistent gegen viele chemische Reaktionen. Die Struktur von C6H6 macht es auch zu einem nützlichen Rohstoff für die Herstellung vieler wichtiger Verbindungen.
| Aussehen | Farblose Flüssigkeit |
| Spezifisches Gewicht | 0,879 g/ml |
| Farbe | Farblos |
| Geruch | Weich |
| Molmasse | 78,11 g/Mol |
| Dichte | 0,879 g/ml |
| Fusionspunkt | 5,5 °C (41,9 °F) |
| Siedepunkt | 80,1 °C (176,2 °F) |
| Blitzpunkt | -11°C (12,2°F) |
| Löslichkeit in Wasser | 1,79 g/l |
| Löslichkeit | Unlöslich in Wasser, löslich in organischen Lösungsmitteln |
| Dampfdruck | 12,1 kPa bei 20°C |
| Wasserdampfdichte | 2,8 (Luft=1) |
| pKa | 43.2 |
| pH-Wert | Neutral |
Sicherheit und Gefahren von Benzol
C6H6 ist eine leicht entzündliche und giftige Verbindung, die erhebliche Risiken für die menschliche Gesundheit und die Umwelt birgt. Es ist ein bekanntes Karzinogen und kann beim Menschen Leukämie, aplastische Anämie und andere Bluterkrankungen verursachen. Die Exposition gegenüber C6H6 kann durch Einatmen, Hautkontakt oder Verschlucken erfolgen und zu akuten und chronischen Gesundheitsschäden führen. Es ist wichtig, beim Umgang mit C6H6 entsprechende Sicherheitsvorkehrungen zu treffen, einschließlich ausreichender Belüftung, Schutzkleidung und Atemschutz. C6H6 sollte außerdem gemäß den örtlichen Vorschriften gelagert und entsorgt werden, um Umweltverschmutzung und Risiken für die öffentliche Gesundheit zu minimieren.
| Gefahrensymbole | Totenkopf, Flamme |
| Sicherheitsbeschreibung | Leicht entzündlich, giftig, krebserregend, gesundheitsschädlich beim Verschlucken, reizend |
| AN-Kennungen | UN 1114 (Benzol), UN 1992 (Entzündbare, giftige Flüssigkeiten) |
| HS-Code | 2902.20.00 |
| Gefahrenklasse | 3 (Brennbare Flüssigkeiten), 6.1 (Giftige Stoffe), 8 (Ätzende Stoffe) |
| Verpackungsgruppe | II (Benzol), III (brennbare, giftige Flüssigkeiten) |
| Toxizität | Akute Toxizität: Sehr giftig (LD50: 2,5 g/kg oral, 0,44 mg/L bei Inhalation), Chronische Toxizität: Karzinogen, Mutagen, Reproduktionstoxizität |
Methoden der Benzolsynthese
Es gibt verschiedene Methoden zur Synthese von Benzol, einer wichtigen Industriechemikalie, die bei der Herstellung von Kunststoffen, Gummi und Arzneimitteln verwendet wird.
Eine gängige Methode ist die katalytische Reformierung von Erdölnaphtha, bei der Naphtha in Gegenwart eines Katalysators wie Platin oder Rhenium auf hohe Temperaturen erhitzt wird, um eine Mischung aromatischer Kohlenwasserstoffe, einschließlich Benzol, zu erzeugen.
Eine andere Methode ist die Hydrodealkylierung von Toluol, bei der Toluol mit Wasserstoff in Gegenwart eines Katalysators wie Chromoxid oder Molybdänoxid umgesetzt wird, um die Methylgruppe zu entfernen und Benzol zu bilden.
Durch die Pyrolyse von Kohlenwasserstoffen wie Kohle oder Erdöl bei hohen Temperaturen und ohne Sauerstoff wird Benzol synthetisiert. Bei diesem Prozess entsteht ein Gemisch aus aromatischen Kohlenwasserstoffen, darunter auch Benzol.
Andere Methoden zur Synthese von Benzol umfassen die Reaktion von Acetylen mit sich selbst in Gegenwart eines Katalysators wie Kupfer zur Bildung von Benzol sowie die Reaktion von Phenol mit Formaldehyd in Gegenwart eines Säurekatalysators wie Schwefelsäure Benzol bilden. Benzol produzieren.
Jede dieser Methoden hat ihre eigenen Vor- und Nachteile, abhängig von Faktoren wie Kosten, Wirksamkeit und Umweltauswirkungen. Die Wahl der Benzolsynthesemethode hängt von der spezifischen Anwendung und den Anforderungen des Produktionsprozesses ab.
Verwendung von Benzol
Benzol ist eine vielseitige und wichtige Industriechemikalie mit einem breiten Anwendungsspektrum in verschiedenen Branchen. Einige der Hauptverwendungszwecke von Benzol sind:
- Kunststoffproduktion: Wird bei der Herstellung verschiedener Arten von Kunststoffen verwendet, darunter Polystyrol, Polyurethan und Nylon.
- Kautschukproduktion: Hersteller von synthetischem Kautschuk verwenden ihn in ihrer Produktion. Anschließend verwenden Hersteller diesen synthetischen Kautschuk zur Herstellung von Reifen, Rohren, Riemen und anderen Gummiprodukten.
- Pharmazeutische Produktion: Wird als Rohstoff für die Herstellung verschiedener pharmazeutischer Produkte verwendet, darunter Antibiotika, Antihistaminika und Analgetika.
- Lösungsmittel: Wird als Lösungsmittel für eine Vielzahl organischer Verbindungen verwendet, darunter Fette, Öle, Harze und Wachse.
- Kraftstoff: Wird als Kraftstoffzusatz mit hoher Oktanzahl verwendet und verbessert die Leistung von Benzinmotoren.
- Ölextraktion: Wird zur Gewinnung von Ölen wie Pflanzenölen und ätherischen Ölen aus Pflanzen verwendet.
- Klebstoffe: Wird bei der Herstellung von Klebstoffen wie Gummizement und Kontaktzement verwendet.
- Farbstoffe: Wird bei der Herstellung verschiedener Arten von Farbstoffen verwendet, einschließlich synthetischer Farbstoffe, die in der Textilindustrie verwendet werden.
Fragen:
F: Ist Benzol polar?
A: Nein, Benzol ist ein unpolares Molekül, da es eine symmetrische Struktur hat und sich die Polaritäten der einzelnen Bindungen aufheben.
F: Wofür wird Benzol verwendet?
A: Benzol wird bei der Herstellung verschiedener Materialien verwendet, darunter Kunststoffe, Gummi, Pharmazeutika, Lösungsmittel, Kraftstoffzusätze, Klebstoffe und Farbstoffe.
F: Welche Verbindung leitet Strom, wenn sie in Wasser gelöst wird? CH4, CuSO4, C6H6 oder C6H12O6?
A: CuSO4 leitet Elektrizität, wenn es in Wasser gelöst ist, da es in Ionen zerfällt, wodurch elektrischer Strom fließen kann.
F: Ist C6H6 polar oder unpolar?
A: C6H6, auch Benzol genannt, ist ein unpolares Molekül, da es eine symmetrische Struktur hat und sich die Polaritäten der einzelnen Bindungen aufheben.
F: Ist C6H6 wasserlöslich?
A: Nein, C6H6 ist nicht wasserlöslich, da es ein unpolares Molekül ist und nicht gut mit polaren Lösungsmitteln wie Wasser interagiert.
