Butanal oder Butyraldehyd ist eine organische Verbindung mit der Formel C4H8O. Es ist eine farblose Flüssigkeit mit stechendem Geruch und wird häufig als Rohstoff für die Synthese anderer Chemikalien verwendet.
| IUPAC-Name | Butanal |
| Molekularformel | C4H8O |
| CAS-Nummer | 123-72-8 |
| Synonyme | Butyraldehyd, Butteraldehyd, Butanaldehyd, Butyral, N-Butanal, Butaldehyd, Butyrylhydrid, 1-Butanal, 1-Butyraldehyd |
| InChI | InChI=1S/C4H8O/c1-2-3-4-5/h4H,2-3H2,1H3 |
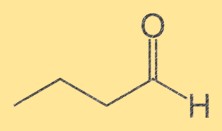
Butanalstruktur
Die Struktur von Butanal besteht aus einer Kette mit vier Kohlenstoffatomen, an die eine endständige Aldehydgruppe (-CHO) gebunden ist. Die Kohlenstoffatome sind fortlaufend nummeriert, wobei die Aldehydgruppe an den ersten Kohlenstoff gebunden ist. Die Struktur von Butanal ist wichtig, da sie seine chemischen und physikalischen Eigenschaften bestimmt.
Butanal-IR-Spektrum
Das Infrarotspektrum (IR) von Butanal wird zur Identifizierung der im Molekül vorhandenen funktionellen Gruppen verwendet. Das IR-Spektrum von Butanal zeigt charakteristische Peaks für die Carbonylgruppe (-C=O) bei etwa 1730 cm-1 und für CH-Streckschwingungen bei etwa 2800-3000 cm-1. Das IR-Spektrum ist in der organischen Chemie ein leistungsstarkes Werkzeug zur Identifizierung und Charakterisierung von Verbindungen.
Molmasse von Butanal
Butanal hat eine Molmasse von 72,11 g/mol. Die Molmasse einer Verbindung ist die Summe der Atommassen aller Atome in einem Molekül dieser Verbindung. Im Fall von Butanal errechnet sich die Molmasse durch Addition der Atommassen von vier Kohlenstoffatomen, acht Wasserstoffatomen und einem Sauerstoffatom.
Siedepunkt von Butanal
Der Siedepunkt von Butanal liegt bei 75 °C oder 167 °F. Dies ist die Temperatur, bei der der Dampfdruck der Flüssigkeit dem Atmosphärendruck entspricht und die Flüssigkeit zu sieden beginnt. Butanal hat einen relativ niedrigen Siedepunkt, wodurch es flüchtig ist und bei Raumtemperatur leicht verdunstet.
Schmelzpunkt von Butanal
Der Schmelzpunkt von Butanal liegt bei -97 °C oder -143 °F. Dies ist die Temperatur, bei der ein fester Stoff in einen flüssigen Zustand übergeht. Butanal hat einen sehr niedrigen Schmelzpunkt, was bedeutet, dass es bei Raumtemperatur normalerweise in flüssigem Zustand vorliegt.
Dichte von Butyraldehyd g/ml
Die Dichte von Butyraldehyd beträgt 0,81 g/ml. Die Dichte ist die Menge an Masse pro Volumeneinheit und wird bei Flüssigkeiten üblicherweise in Gramm pro Milliliter ausgedrückt. Butyraldehyd hat eine geringere Dichte als Wasser, das heißt, es schwimmt auf der Wasseroberfläche.
Molekulargewicht von Butyraldehyd
Das Molekulargewicht von Butyraldehyd beträgt 72,11 g/mol. Sie entspricht der Molmasse und gibt die Masse eines Butyraldehydmoleküls an. Das Molekulargewicht ist ein wichtiger Parameter für chemische Berechnungen und Analysen.
Butyraldehyd-Formel
Die chemische Formel für Butyraldehyd lautet C4H8O. Diese Formel gibt die Anzahl der Atome jedes Elements in einem Butyraldehydmolekül an. Butyraldehyd enthält vier Kohlenstoffatome, acht Wasserstoffatome und ein Sauerstoffatom.
| Aussehen | Farblose Flüssigkeit |
| Spezifisches Gewicht | 0,81 g/ml |
| Farbe | Farblos |
| Geruch | Würzig, scharf |
| Molmasse | 72,11 g/Mol |
| Dichte | 0,81 g/ml |
| Fusionspunkt | -97°C (-143°F) |
| Siedepunkt | 75°C (167°F) |
| Blitzpunkt | -6,7 °C (20 °F) |
| Löslichkeit in Wasser | Mischbar |
| Löslichkeit | Löslich in Ethanol, Ether, Aceton |
| Dampfdruck | 44 mmHg bei 20°C |
| Wasserdampfdichte | 2,5 (Luft=1) |
| pKa | 16.92 |
| pH-Wert | 4,5-6,5 |
Sicherheit und Gefahren von Butanal
Butyraldehyd ist eine brennbare Flüssigkeit und kann bei Einwirkung von Hitze oder Flammen eine Brandgefahr darstellen. Außerdem kann es bei Kontakt zu Augen- und Hautreizungen kommen, und das Einatmen von Dämpfen kann zu Reizungen der Atemwege führen. Daher ist es wichtig, mit Butyraldehyd vorsichtig umzugehen und geeignete persönliche Schutzausrüstung wie Handschuhe und Schutzbrille zu tragen. Es sollte an einem kühlen, trockenen und gut belüfteten Ort, entfernt von Wärme- und Zündquellen, gelagert werden. Bei Exposition oder Verschlucken sofort einen Arzt aufsuchen. Es ist außerdem wichtig, ordnungsgemäße Abfallentsorgungsverfahren für Butyraldehyd einzuhalten, um eine Kontamination der Umwelt zu verhindern.
| Gefahrensymbole | Flamme, Ätzend, Reizend |
| Sicherheitsbeschreibung | Von Hitze/Funken/offener Flamme/heißen Oberflächen fernhalten. Schutzhandschuhe/Augenschutz/Gesichtsschutz tragen. BEI BERÜHRUNG MIT DER HAUT (oder dem Haar): Alle kontaminierten Kleidungsstücke sofort ausziehen. Haut mit Wasser abspülen/duschen. Im Brandfall: Trockenlöschpulver zum Löschen verwenden. |
| UN-Identifikationsnummern | UN1125 |
| HS-Code | 2912.19.00 |
| Gefahrenklasse | 3 |
| Verpackungsgruppe | II |
| Toxizität | Butanal ist schädlich, wenn es eingenommen, eingeatmet oder über die Haut aufgenommen wird. Es kann Augen- und Hautreizungen verursachen und eine längere Exposition kann zu Leber- und Nierenschäden führen. In Tierversuchen wurde außerdem gezeigt, dass es mutagen und krebserregend ist. Die ordnungsgemäße Handhabung und Entsorgung ist wichtig, um Exposition und Kontamination zu verhindern. |
Butanal-Synthesemethoden
Butyraldehyd kann durch verschiedene Methoden synthetisiert werden, einschließlich der Oxidation primärer Alkohole, der Ozonolyse von Alkenen und der Hydroformylierung von Alkenen.
Eine übliche Methode zur Synthese von Butyraldehyd ist die Oxidation primärer Alkohole mit einem Oxidationsmittel wie Kaliumpermanganat oder Chromsäure. Der primäre Alkohol wird zunächst mit einem milden Reduktionsmittel wie Pyridiniumchlorchromat in den entsprechenden Aldehyd umgewandelt und anschließend zu Butyraldehyd oxidiert. Eine andere Methode beinhaltet die Ozonolyse von Alkenen zur Herstellung von Aldehyden, die dann mit einem Reduktionsmittel wie Natriumborhydrid zu Butyraldehyd reduziert werden können.
Die Hydroformylierung von Alkenen ist ebenfalls eine häufig verwendete Methode zur Synthese von Butyraldehyd. Dabei erfolgt die Reaktion des Alkens mit Kohlenmonoxid und Wasserstoffgas in Gegenwart eines Katalysators wie einem Kobaltcarbonyl- oder Rhodiumkomplex. Der resultierende Aldehyd kann dann mit einem Reduktionsmittel wie Lithiumaluminiumhydrid zu Butyraldehyd reduziert werden.
Andere Methoden zur Synthese von Butyraldehyd umfassen die Reaktion von Grignard-Reagenzien mit Formaldehyd und die Reaktion von Ketonen mit Ameisensäure und Wasserstoffgas in Gegenwart eines Katalysators.
Insgesamt hängt die Wahl der Synthesemethode von Faktoren wie der Verfügbarkeit der Rohstoffe, der gewünschten Ausbeute und Reinheit sowie der Durchführbarkeit der Reaktionsbedingungen ab.
Verwendungsmöglichkeiten von Butanal
Aufgrund seiner Reaktivität und seines ausgeprägten Geruchs findet Butanal vielfältige industrielle und kommerzielle Verwendungsmöglichkeiten.
Butanal wird hauptsächlich als Rohstoff für die Herstellung anderer Chemikalien wie Butylacrylat und n-Butanol verwendet. Diese Chemikalien werden bei der Herstellung von Beschichtungen, Klebstoffen und Kunststoffen verwendet.
Butanal wird auch als Aromastoff in der Lebensmittelindustrie verwendet und verleiht verschiedenen Produkten wie Backwaren, Süßigkeiten und Getränken ein fruchtiges, apfelartiges Aroma. Es wird auch als Duftstoff in Parfüms und Seifen verwendet.
Darüber hinaus wird Butanal als Lösungsmittel in der organischen Synthese und als Reagens in Reaktionen der organischen Chemie verwendet. Es kann zur Umwandlung von Aldehyden in sekundäre Alkohole und zur Herstellung von Estern durch Reaktion mit Carbonsäuren verwendet werden.
Butanal wurde aufgrund seines starken Geruchs auch in Forschungsstudien als Hilfsmittel zum Verständnis der Mechanismen der Aktivierung von Geruchsrezeptoren im Gehirn eingesetzt.
Es ist jedoch wichtig zu beachten, dass Butanal bei unsachgemäßer Handhabung ein Sicherheitsrisiko darstellen kann und bei der Verwendung und Lagerung entsprechende Vorsichtsmaßnahmen getroffen werden sollten. Insgesamt machen die Vielseitigkeit und die einzigartigen Eigenschaften von Butanal es zu einer wichtigen Chemikalie in verschiedenen Industrien und Forschungsbereichen.
Fragen:
Was ist die Standardbildungsenthalpie von flüssigem Butyraldehyd, ch3ch2ch2cho(l)?
Die Standardbildungsenthalpie (∆H°f) von flüssigem Butyraldehyd (CH3CH2CH2CHO(l)) bei 25 °C beträgt -146,6 kJ/mol.
Dies bedeutet, dass die Enthalpieänderung, die mit der Bildung von 1 Mol flüssigem Butyraldehyd aus seinen Bestandteilen in ihren Standardzuständen (in diesem Fall Kohlenstoff, Wasserstoff und Sauerstoff in ihren elementaren Formen) verbunden ist, -146,6 kJ/mol bei 25 °C beträgt . und 1 atm Druck.
Das negative Vorzeichen zeigt an, dass die Reaktion exotherm ist, also Wärme freisetzt. Dieser Wert ist nützlich für die Berechnung der Enthalpieänderung von Reaktionen, an denen Butyraldehyd als Reaktant oder Produkt beteiligt ist.
