Bromthymolblau (BTB) ist ein pH-Indikator, der in Gegenwart einer basischen Lösung seine Farbe von Gelb nach Blau ändert. Es wird häufig in wissenschaftlichen Experimenten und als medizinisches Diagnoseinstrument verwendet.
| IUPAC-Name | 3′,3“-Dibromthymolsulfonphthalein |
| Molekularformel | C27H28Br2O5S |
| CAS-Nummer | 76-59-5 |
| Synonyme | Bromthymolsulfonphthalein; 4,4′-(1,1-Dioxido-3H-2,1-benzoxathiol-3,3-diyl)bis(2-brom-3-methyl-6-(1-methylethyl)phenol) |
| InChI | InChI=1S/C27H28Br2O5S/c1-13(2)17-11-20(15(5)23(28)18(17)7-9-19(24(20)29)8-10-21(27) 22(30)12-25(31)32)37(33,34)36-26-14(3)6-4-16(35-26)24-7-9-29-11-10-23( 24)28/h4-7,9-12,31-32H,8H2,1-3H3 |
Bromthymolblau Molmasse
BTB hat eine Molmasse von 624,38 g/mol. Die Molmasse ist die Masse eines Mols einer Substanz und wird üblicherweise bei Berechnungen chemischer Reaktionen verwendet. Die Molmasse von BTB wird durch Addition der Atomgewichte aller Atome in seiner chemischen Formel berechnet, die C27H28Br2O5S ist. Die Kenntnis der Molmasse einer Substanz ist wichtig, um die Menge der Substanz zu bestimmen, die für eine bestimmte Reaktion benötigt wird, und um die Menge des bei einer Reaktion erzeugten Produkts zu bestimmen.
Siedepunkt von Bromthymolblau
BTB hat einen Siedepunkt von 636,3 °C bei 760 mmHg. Der Siedepunkt ist die Temperatur, bei der ein Stoff bei einem bestimmten Druck vom flüssigen in den gasförmigen Zustand übergeht. Der hohe Siedepunkt von BTB weist darauf hin, dass es sich um eine stabile Verbindung handelt, die unter normalen Bedingungen nicht verdampft oder sich leicht zersetzt. Der Siedepunkt eines Stoffes kann zur Bestimmung seiner Reinheit herangezogen werden, da Verunreinigungen den Siedepunkt verändern können.
Bromthymolblau Schmelzpunkt
BTB hat einen Schmelzpunkt von 165–170 °C. Der Schmelzpunkt ist die Temperatur, bei der ein fester Stoff von seinem festen in seinen flüssigen Zustand übergeht. Der Schmelzpunkt eines Stoffes dient zur Identifizierung und Charakterisierung, da verschiedene Stoffe unterschiedliche Schmelzpunkte haben. Der Schmelzpunkt von BTB ist relativ hoch, was darauf hinweist, dass es sich um eine stabile Verbindung handelt, die sich nicht leicht zersetzt.
Bromthymolblau Dichte g/ml
BTB hat eine Dichte von 1,36 g/ml. Die Dichte ist die Masse einer Substanz pro Volumeneinheit und misst, wie dicht die Moleküle in einer Substanz sind. Die Dichte von BTB weist darauf hin, dass es sich um eine relativ dichte Verbindung handelt und wird üblicherweise als Standard bei Dichtemessungen verwendet.
Molekulargewicht von Bromthymolblau
Das Molekulargewicht von BTB beträgt 624,38 g/mol. Das Molekulargewicht ist die Summe der Atomgewichte aller Atome in einem Molekül und ein wichtiger Faktor bei chemischen Reaktionen. Das Molekulargewicht von BTB wird verwendet, um die für eine bestimmte Reaktion benötigte Substanzmenge sowie die bei einer Reaktion erzeugte Produktmenge zu bestimmen.
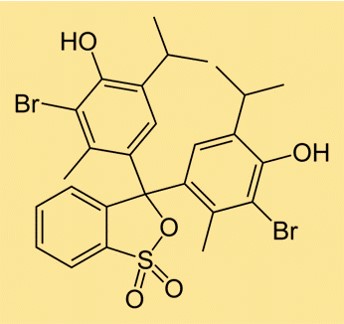
Struktur von Bromthymolblau
Die Struktur von BTB besteht aus zwei aromatischen Ringen, an die jeweils ein Bromatom gebunden ist. An einem der Ringe ist außerdem eine Sulfonatgruppe angebracht, die das Molekül wasserlöslich macht. Die Struktur von BTB ähnelt anderen pH-Indikatoren, die zur Bestimmung des Säuregehalts oder der Basizität einer Lösung verwendet werden.
Bromthymolblau-Formel
Die chemische Formel von BTB lautet C27H28Br2O5S. Die Formel gibt die Anzahl und Art der Atome im Molekül an und wird bei chemischen Reaktionen verwendet, um die für eine bestimmte Reaktion benötigte Stoffmenge zu bestimmen. Die Formel für BTB zeigt, dass es zwei Bromatome enthält, die ihm in sauren Lösungen seine charakteristische gelbgrüne Farbe verleihen, und eine Sulfonatgruppe, die es wasserlöslich macht.
| Aussehen | Dunkelgrünes Pulver |
| Spezifisches Gewicht | 1,36 |
| Farbe | gelblich-grün |
| Geruch | Geruchlos |
| Molmasse | 624,38 g/Mol |
| Dichte | 1,36 g/ml |
| Fusionspunkt | 165-170°C |
| Siedepunkt | 636,3°C bei 760 mmHg |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Löslich |
| Löslichkeit | Löslich in Ethanol, schwer löslich in Ether und Chloroform |
| Dampfdruck | Unzutreffend |
| Wasserdampfdichte | Unzutreffend |
| pKa | 6.3 |
| pH-Wert | Gelb bei pH 6,0, grün bei pH 7,6, blau bei pH 7,9 |
Sicherheit und Gefahren von Bromthymolblau
BTB kann schädlich sein, wenn es eingenommen, eingeatmet oder über die Haut aufgenommen wird. Dies kann zu Reizungen der Augen, der Haut und der Atemwege führen. Beim Verschlucken kann es zu Magen-Darm-Reizungen, Übelkeit, Erbrechen und Bauchschmerzen kommen. Das Einatmen von BTB-Staub oder -Dampf kann zu Reizungen der Atemwege, Husten und Atembeschwerden führen. Der Stoff kann auch für Wasserlebewesen schädlich sein und sollte nicht in Gewässer entsorgt werden. Beim Umgang mit BTB sollte geeignete persönliche Schutzausrüstung wie Handschuhe und Augenschutz getragen werden. Die Verwendung und Entsorgung sollte gemäß den entsprechenden Laborverfahren und -vorschriften erfolgen.
| Gefahrensymbole | Keiner |
| Sicherheitsbeschreibung | S22: Staub nicht einatmen. S24/25: Kontakt mit Haut und Augen vermeiden. S36/37/39: Geeignete Schutzkleidung, Handschuhe und Augen-/Gesichtsschutz tragen. |
| AN-Kennungen | Nicht reguliert |
| HS-Code | 2921.59.90 |
| Gefahrenklasse | Nicht klassifiziert |
| Verpackungsgruppe | Unzutreffend |
| Toxizität | LD50 (oral, Ratte) = 4.500 mg/kg |
Methoden zur Synthese von Bromthymolblau
Es gibt verschiedene Methoden zur Synthese von BTB.
Eine übliche Methode ist die Reaktion zwischen Thymolblau und Brom in Gegenwart eines starken Säurekatalysators wie Salzsäure. Die Reaktion verläuft durch elektrophile Addition von Brom an das Thymolblau-Molekül, gefolgt von der Substitution eines Wasserstoffatoms durch ein Bromatom. Die resultierende Verbindung ist BTB.
Eine andere Methode beinhaltet die Reaktion zwischen 2,6-Dibromindophenol und Kresolrot in Gegenwart eines starken Säurekatalysators. Die Reaktion erfolgt durch elektrophile Substitution eines Wasserstoffatoms im Kresolrot-Molekül durch ein Bromatom im 2,6-Dibromindophenol-Molekül. Die resultierende Verbindung ist BTB.
Eine dritte Methode beinhaltet die Reaktion zwischen Thymolblau und Natriumbromid in Gegenwart von Natriumhydroxid. Die Reaktion findet statt, indem ein Wasserstoffatom im Thymolblau-Molekül durch ein Bromatom aus dem Natriumbromid-Molekül ersetzt wird. Die resultierende Verbindung ist BTB.
Unabhängig von der verwendeten Methode muss das resultierende Produkt durch Umkristallisation oder Säulenchromatographie gereinigt werden, um reines BTB zu erhalten.
Verwendungsmöglichkeiten von Bromthymolblau
BTB hat mehrere Anwendungen in verschiedenen Bereichen. Zu den Einsatzmöglichkeiten von BTB gehören:
- Indikator: Wird als Säure-Base-Indikator mit einem pH-Bereich von 6,0 bis 7,6 verwendet. Bei pH 6,0 ist es gelb, bei pH 7,6 grün und bei pH 7,9 blau.
- Laborexperimente: Wird in verschiedenen Laborexperimenten verwendet, um das Vorhandensein von Kohlendioxid und anderen Gasen zu testen und den Atmungsquotienten zu bestimmen.
- Aquakultur: Wird in der Aquakultur verwendet, um den pH-Wert des Wassers in Aquarien und Teichen zu überwachen.
- Medizinischer Bereich: Wird verwendet, um das Vorhandensein von Galle in Urinproben zu testen und das Vorhandensein von Pilzinfektionen festzustellen.
- Bildung: Wird in der Bildung als visuelles Hilfsmittel verwendet, um die Prinzipien von Säure-Base-Reaktionen zu demonstrieren und Schülern den pH-Wert beizubringen.
- Agrarindustrie: Wird zur Messung des pH-Werts im Boden verwendet, ein wichtiger Faktor für die Gesundheit und das Wachstum von Pflanzen.
- Umwelttests: Wird bei Umwelttests verwendet, um den pH-Wert von Wasserquellen wie Seen und Flüssen zu messen, um deren Eignung für Wasserlebewesen sicherzustellen.
Insgesamt ist BTB eine vielseitige Verbindung mit vielen Anwendungen in verschiedenen Bereichen.
Fragen:
F: Was ist Bromthymolblau?
A: BTB ist ein pH-Indikator, der häufig in Laborexperimenten und verschiedenen anderen Anwendungen verwendet wird. Es handelt sich um eine chemische Verbindung, die je nach Säuregehalt oder Alkalität einer Lösung ihre Farbe ändert.
F: Was ist der pH-Bereich von Bromthymolblau?
A: Der pH-Bereich von BTB liegt zwischen 6,0 und 7,6. Bei pH 6,0 ist es gelb, bei pH 7,6 grün und bei pH 7,9 blau.
F: Wie verändert sich die Farbe von Bromthymolblau?
A: Die Farbänderung von BTB hängt vom pH-Wert der Lösung ab. Bei pH 6,0 ist es gelb, bei pH 7,6 grün und bei pH 7,9 blau.
F: Ist Bromthymolblau eine Säure oder eine Base? A: BTB ist weder eine Säure noch eine Base. Es handelt sich um einen Indikator, der je nach Säuregehalt oder Alkalität einer Lösung seine Farbe ändert.
