Brom (Br2) ist ein zweiatomiges Molekül, das aus zwei Bromatomen besteht. Es ist bei Raumtemperatur eine rotbraune Flüssigkeit und sehr reaktiv. Es wird in verschiedenen Branchen eingesetzt, darunter in der Pharmaindustrie, der Landwirtschaft und der Wasseraufbereitung.
| IUPAC-Name | Brom |
| Molekularformel | Br2 |
| CAS-Nummer | 7726-95-6 |
| Synonyme | Brom, molekulares Brom, UN 1744, zweiatomiges Brom, Brom-79, Brom-81 |
| InChI | InChI=1S/Br2/c1-2 |
Eigenschaften von Brom
Bromformel
Die chemische Formel für Brom lautet Br2. Das bedeutet, dass ein Brommolekül zwei Bromatome enthält. Die Formel wird verwendet, um die Zusammensetzung eines Stoffes darzustellen und ist bei chemischen Reaktionen von wesentlicher Bedeutung. Die Bromformel wird in verschiedenen Branchen eingesetzt, darunter in der Pharmaindustrie, der Wasseraufbereitung und der Landwirtschaft.
Molmasse von Brom
Die Molmasse von Br2 beträgt 159,808 g/mol. Es handelt sich um die Masse eines Mols Br2-Molekülen. Die Molmasse ist eine wesentliche Eigenschaft in der Chemie, da sie hilft, die für eine bestimmte Reaktion benötigte Substanzmenge zu bestimmen. Es wird auch verwendet, um Gramm und Mol einer Substanz umzurechnen.
Siedepunkt von Brom
Br2 hat einen Siedepunkt von 58,8 °C (137,8 °F). Dies ist die Temperatur, bei der Br2 vom flüssigen in den gasförmigen Zustand übergeht. Der niedrige Siedepunkt von Br2 ist auf seine schwachen intermolekularen Kräfte zurückzuführen, die es Molekülen ermöglichen, leichter aus dem flüssigen Zustand zu entkommen. Die hohe Reaktivität von Br2 macht den Umgang mit Br2 bei hohen Temperaturen zu einem gefährlichen Stoff.
Schmelzpunkt von Brom
Der Schmelzpunkt von Br2 beträgt -7,2 °C (19,0 °F). Dies ist die Temperatur, bei der festes Br2 in den flüssigen Zustand übergeht. Der niedrige Schmelzpunkt von Br2 ist auf seine schwachen intermolekularen Kräfte zurückzuführen, die es Molekülen ermöglichen, sich im festen Zustand leichter zu bewegen. Br2 hat die einzigartige Eigenschaft, bei Raumtemperatur in flüssiger Form vorzuliegen, was bei Halogenen selten vorkommt.
Bromdichte g/ml
Die Dichte von Br2 beträgt 3,12 g/ml. Das bedeutet, dass ein Milliliter Br2 eine Masse von 3,12 Gramm hat. Die hohe Dichte von Br2 ist auf sein Molekulargewicht und die Festigkeit seiner Moleküle im flüssigen Zustand zurückzuführen. Die hohe Dichte von Br2 macht es für schwere organische Synthesereaktionen nützlich.
Molekulargewicht von Brom
Das Molekulargewicht von Br2 beträgt 79,90 g/mol. Es ist die Summe der Atomgewichte der beiden Br-Atome im Br2-Molekül. Das Molekulargewicht ist eine wesentliche Eigenschaft in der Chemie, da es hilft, die für eine bestimmte Reaktion benötigte Substanzmenge zu bestimmen.
Struktur von Brom
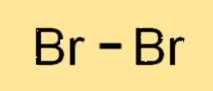
Br2 ist ein zweiatomiges Molekül, das heißt, es besteht aus zwei miteinander verbundenen Br-Atomen. Die beiden Br2-Atome teilen sich ein Elektronenpaar und bilden eine kovalente Bindung. Das Br2-Molekül hat eine lineare Struktur, wobei die beiden Br-Atome in einer geraden Linie angeordnet sind. Die Struktur von Br2 ähnelt anderen Halogenen wie Chlor und Jod.
| Aussehen | Rötlich-braune Flüssigkeit |
| Spezifisches Gewicht | 3,12 g/ml |
| Farbe | rötlich-braun |
| Geruch | Stechender und irritierender Geruch |
| Molmasse | 159.808 g/Mol |
| Dichte | 3,12 g/ml |
| Fusionspunkt | -7,2 °C (19,0 °F) |
| Siedepunkt | 58,8 °C (137,8 °F) |
| Blitzpunkt | Nicht brennbar |
| Löslichkeit in Wasser | 3,41 g/100 ml (25 °C) |
| Löslichkeit | Löslich in Chloroform, Tetrachlorkohlenstoff und Ether |
| Dampfdruck | 1,13 kPa bei 25 °C |
| Wasserdampfdichte | 5,4 g/L |
| pKa | -5 |
| pH-Wert | Unzutreffend |
Sicherheit und Gefahren von Brom
Br2 ist eine gefährliche Chemikalie und sollte mit Vorsicht gehandhabt werden. Es handelt sich um eine ätzende Flüssigkeit, die schwere Reizungen der Haut und der Augen verursachen kann. Das Einatmen von Br2-Dämpfen kann Atemprobleme verursachen und die Exposition gegenüber hohen Konzentrationen kann tödlich sein. Br2 ist außerdem ein starkes Oxidationsmittel und kann mit brennbaren Materialien heftig reagieren und Brände oder Explosionen verursachen. Bei der Arbeit mit Br2 sollte stets geeignete Schutzausrüstung wie Handschuhe, Schutzbrille und Atemschutzmaske getragen werden. Es sollte an einem kühlen, trockenen und gut belüfteten Ort, entfernt von Wärmequellen und inkompatiblen Materialien, gelagert werden. Im Falle einer Verschüttung oder eines Unfalls evakuieren Sie den Bereich sofort und befolgen Sie die ordnungsgemäßen Reinigungsverfahren.
| Gefahrensymbole | Totenkopf, ätzend |
| Sicherheitsbeschreibung | Sehr giftig, ätzend und reizend für Haut, Augen und Atemwege. |
| UN-Identifikationsnummern | UN1744 |
| HS-Code | 2801.30 |
| Gefahrenklasse | 8 |
| Verpackungsgruppe | II |
| Toxizität | LD50 (oral, Ratte) = 2 bis 3 mg/kg |
Methoden der Bromsynthese
Je nach gewünschter Reinheit und Menge können unterschiedliche Methoden zur Synthese von Br2 eingesetzt werden.
Eine Methode besteht darin, Sole mit Chlorgas in Gegenwart eines Katalysators wie Eisen zu behandeln. Die resultierende Lösung aus Natriumhypochlorit und Natriumchlorid wird dann mit Salzsäure angesäuert, wodurch Br2-Gas freigesetzt wird.
Eine andere Methode beinhaltet die Oxidation von Bromwasserstoffgas mit Sauerstoffgas in Gegenwart eines Katalysators wie Platin oder Asbest. In der Industrie wird diese Methode üblicherweise zur Herstellung von hochreinem Br2 für ihre Anwendungen eingesetzt.
Durch Elektrolyse wird Br2 aus der Sole extrahiert, indem ein elektrischer Strom durch die Lösung geleitet wird, der die Natrium- und Chloridionen trennt und als Nebenprodukt Br2-Gas erzeugt.
Verwendung von Brom
Br2 hat mehrere wichtige Einsatzmöglichkeiten in verschiedenen Branchen, darunter:
- Hersteller verwenden Br-basierte Verbindungen als Flammschutzmittel in Textilien, Kunststoffen und elektronischen Geräten, um die Brandgefahr zu verringern, indem sie die Ausbreitung von Flammen verhindern.
- Pharmaunternehmen verwenden Br-basierte Verbindungen bei der Herstellung verschiedener Beruhigungsmittel, Beruhigungsmittel und Analgetika.
- Wasseraufbereitungsanlagen nutzen Br-basierte Verbindungen als Desinfektionsmittel, um Bakterien, Viren und andere Schadorganismen wirksam abzutöten.
- Hersteller von Pestiziden und Herbiziden verwenden Br-basierte Verbindungen, um Schädlinge und Unkräuter wirksam zu bekämpfen.
- Die Öl- und Gasindustrie verwendet Br-basierte Verbindungen bei Bohrarbeiten, um Korrosion zu kontrollieren und die Ölförderung zu verbessern.
- Hersteller verwenden Br-basierte Verbindungen bei der Herstellung von Fotofilmen und -papieren, um die Empfindlichkeit und den Kontrast von Bildern effektiv zu steuern.
- Chemische Synthesereaktionen nutzen Br2 als Reaktant zur Herstellung von Farbstoffen, Kunststoffen und Pharmazeutika.
Fragen:
F: Ist Br2 polar oder unpolar?
A: Br2 ist ein unpolares Molekül, da beide Bromatome die gleiche Elektronegativität haben, was zu einer gleichmäßigen Verteilung der Elektronen in der kovalenten Bindung führt.
F: Welche Verbindung enthält höchstwahrscheinlich polare kovalente Bindungen? NaCl, AlF3, Br2, NF3?
A: Die Verbindung, die höchstwahrscheinlich polare kovalente Bindungen enthält, ist NF3 (Stickstofftrifluorid), da Stickstoff- und Fluoratome sehr unterschiedliche Elektronegativitäten haben, was zu einer ungleichen Verteilung der Elektronen in der kovalenten Bindung führt.
F: Was ist ΔH0 für diese Reaktion? Br2 (g) → Br2 (l), ΔHf° Br2 (g) = 30,91 kJ/mol
A: Der ΔH0 für die Reaktion beträgt -10,57 kJ/mol, da die Verdampfungswärme von Br2 41,48 kJ/mol und die Schmelzwärme 30,91 kJ/mol beträgt (in der Frage angegeben).
F: Ist Br2 ein Gas?
A: Br2 kann je nach Temperatur- und Druckbedingungen in gasförmigem und flüssigem Zustand vorliegen. Bei Raumtemperatur und Normaldruck ist Br2 eine rotbraune Flüssigkeit.
F: Wofür wird Brom verwendet?
A: Brom hat mehrere wichtige Verwendungsmöglichkeiten in verschiedenen Branchen, darunter Flammschutzmittel, Wasseraufbereitung, Pharmazeutika, Pestizide, die Öl- und Gasindustrie, Fotografie und chemische Synthese.
F: Ist Brom ein Metall?
A: Nein, Brom ist kein Metall. Es ist ein nichtmetallisches Element in der Halogengruppe des Periodensystems.
