Calciumoxid, auch Branntkalk genannt, ist eine weiße, alkalische Substanz mit hohem Schmelzpunkt. Es reagiert heftig mit Wasser unter Bildung von Calciumhydroxid und erzeugt erhebliche Wärme. Es wird in verschiedenen industriellen Anwendungen eingesetzt, darunter in der Zementherstellung, in der Landwirtschaft und in der Wasseraufbereitung.
| IUPAC-Name | Calciumoxid |
| Molekularformel | CaO |
| CAS-Nummer | 1305-78-8 |
| Synonyme | Branntkalk; Gebrannter Kalk; Kalk; Calx; Ungelöschter Kalk; Calcium(II)-oxid; Kalzium; Kalkkiesel; Kalksteinfelsen; Calciummonoxid; Fondant-Limette |
| InChI | InChI=1S/Ca.O |
Eigenschaften von Calciumoxid
Calciumoxid-Formel
Die chemische Formel für Calciumoxid lautet CaO, was darauf hinweist, dass es ein Calciumkation (Ca2+) und ein Oxidanion (O2-) enthält. Die Formel von Calciumoxid spiegelt seine ionische Natur wider, bei der Calciumkationen und Oxidanionen durch starke elektrostatische Kräfte zusammengehalten werden. Die Calciumoxidformel wird verwendet, um die Verbindung in verschiedenen chemischen Reaktionen zu identifizieren und ihr Molekulargewicht und andere physikalische Eigenschaften zu berechnen.
Molmasse von Calciumoxid
Die Molmasse von Calciumoxid, auch Branntkalk genannt, beträgt 56.077 Gramm pro Mol. Sie ergibt sich aus dem Atomgewicht von Calcium (40,078 g/mol) und Sauerstoff (15,999 g/mol), aus denen die Verbindung besteht. Die Molmasse von Calciumoxid wird in verschiedenen Berechnungen verwendet, beispielsweise zur Bestimmung der Menge an Reaktanten, die zur Herstellung einer bestimmten Produktmenge benötigt wird, oder zur Berechnung der Konzentration einer Lösung.
Siedepunkt von Calciumoxid
Calciumoxid hat keinen Siedepunkt, da es bei hohen Temperaturen thermisch zersetzt wird, anstatt zu sieden. Bei Temperaturen über 2572 °C zerfällt Calciumoxid in Calcium und Sauerstoff. Durch die thermische Zersetzung von Calciumoxid kann jedoch Calciumoxid mit höherer Reinheit und Reaktivität für industrielle Anwendungen hergestellt werden.
Schmelzpunkt von Calciumoxid
Der Schmelzpunkt von Calciumoxid liegt bei 2572 °C, was es zu einer Substanz mit hohem Schmelzpunkt macht. Aufgrund seiner ionischen Natur, bei der Calciumkationen und Oxidanionen durch starke elektrostatische Kräfte zusammengehalten werden, hat es einen hohen Schmelzpunkt. Der hohe Schmelzpunkt von Calciumoxid macht es auch für Hochtemperaturanwendungen wie die Stahl- und Zementherstellung nützlich.
Dichte von Calciumoxid g/ml
Die Dichte von Calciumoxid variiert je nach Kristallstruktur und Reinheit. Die typische Dichte von Calciumoxid beträgt 3,35 g/ml für Massenmaterial, während die theoretische Dichte 3,50 g/ml beträgt. Die geringe Dichte von Calciumoxid ist auf seine poröse Struktur zurückzuführen, die es ihm ermöglicht, Feuchtigkeit aus der Luft aufzunehmen und sein Gewicht und Volumen zu erhöhen.
Molekulargewicht von Calciumoxid
Das Molekulargewicht von Calciumoxid, auch Formelgewicht oder Molmasse genannt, beträgt 56,077 Gramm pro Mol. Sie wird durch Addition der Atomgewichte von Kalzium und Sauerstoff berechnet, aus denen die Verbindung besteht. Das Molekulargewicht von Calciumoxid wird in verschiedenen Berechnungen verwendet, beispielsweise zur Bestimmung der Menge an Reaktanten, die zur Herstellung einer bestimmten Produktmenge benötigt wird, oder zur Berechnung der Konzentration einer Lösung.
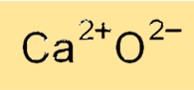
Struktur von Calciumoxid
Calciumoxid hat eine kubische Kristallstruktur, bei der die Calciumkationen und Oxidanionen in einem flächenzentrierten kubischen Gitter angeordnet sind. Die Kristallstruktur von Calciumoxid ähnelt der von Natriumchlorid und anderen ionischen Verbindungen. Die ionische Natur von Calciumoxid macht es zu einem guten elektrischen Isolator und zu einem wichtigen Material bei der Herstellung elektronischer Komponenten.
| Aussehen | Weißer, geruchloser Feststoff |
| Spezifisches Gewicht | 3,35 g/cm³ |
| Farbe | Weiß |
| Geruch | Geruchlos |
| Molmasse | 56,077 g/Mol |
| Dichte | 3,35 g/cm³ |
| Fusionspunkt | 2572°C |
| Siedepunkt | Siedet nicht, zersetzt sich thermisch |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Reagiert mit Wasser unter Bildung von Calciumhydroxid |
| Löslichkeit | Unlöslich in Wasser, löslich in Säure |
| Dampfdruck | Unerheblich |
| Wasserdampfdichte | Unzutreffend |
| pKa | Unzutreffend |
| pH-Wert | 12-13 |
Sicherheit und Gefahren von Calciumoxid
Calciumoxid, auch Branntkalk genannt, ist ein hochreaktiver und ätzender Stoff, der verschiedene Gefahren für die menschliche Gesundheit und die Umwelt mit sich bringt. Bei unsachgemäßer Handhabung kann es zu schweren Reizungen und Verbrennungen der Haut, Augen und Atemwege kommen. Das Einatmen von Branntkalkstaub oder -dampf kann zu Atemnot, Husten und Kurzatmigkeit führen. Außerdem reagiert es sehr reaktiv mit Wasser und kann große Mengen Wärme freisetzen, was zu Verbrennungen und Dampfexplosionen führen kann. Branntkalk sollte an einem kühlen, trockenen und gut belüfteten Ort, entfernt von unverträglichen Substanzen, gelagert werden. Zur Vermeidung von Unfällen und Exposition sollten geeignete Schutzausrüstungen und Handhabungsverfahren befolgt werden.
| Gefahrensymbole | Ätzend (C) |
| Sicherheitsbeschreibung | Tragen Sie Handschuhe, Kleidung und Augen-/Gesichtsschutz. Vorsichtig handhaben und lagern. Einatmen, Verschlucken und Kontakt mit Haut und Augen vermeiden. |
| UN-Identifikationsnummern | UN1910 |
| HS-Code | 2522.20.00 |
| Gefahrenklasse | 8 – Ätzende Stoffe |
| Verpackungsgruppe | II |
| Toxizität | Sehr giftig |
Methoden zur Calciumoxid-Synthese
Durch die thermische Zersetzung von Kalkstein, die Reaktion von Calciumhydroxid mit Hitze und die Elektrolyse von Calciumchlorid entsteht Calciumoxid oder Branntkalk.
Die gebräuchlichste Methode zur Synthese von Branntkalk besteht darin, den Kalk in einem Kalkofen auf eine hohe Temperatur von etwa 900 bis 1000 °C zu erhitzen. Dieser als Kalzinierung bezeichnete Prozess setzt Kohlendioxid frei und hinterlässt Branntkalk. Durch die Verarbeitung und Mahlung von Branntkalk entsteht ein feines Pulver für vielfältige Anwendungen.
Eine andere Methode zur Synthese von Branntkalk besteht darin, Calciumhydroxid, auch gelöschter Kalk genannt, auf eine hohe Temperatur zu erhitzen. Dieser als Dehydroxylierung bezeichnete Prozess setzt ebenfalls Wasser frei und hinterlässt Branntkalk.
Die Calciumchlorid- Elektrolyse ist eine weniger verbreitete Methode zur Synthese von Branntkalk. Lösen Sie Calciumchlorid in Wasser und leiten Sie einen elektrischen Strom durch die Lösung, um Branntkalk und Chlorgas zu erzeugen.
Verwendung von Calciumoxid
Calciumoxid, auch Branntkalk genannt, findet aufgrund seiner einzigartigen Eigenschaften vielfältige Verwendungsmöglichkeiten in verschiedenen Branchen. Einige seiner Hauptanwendungen sind:
- Stahlproduktion: Wird als Flussmittel in der Stahlproduktion verwendet, wo es zur Entfernung von Verunreinigungen und zur Verbesserung der Stahlqualität beiträgt.
- Wasseraufbereitung: Wird bei der Wasseraufbereitung verwendet, um Verunreinigungen zu entfernen und den pH-Wert des Wassers anzupassen.
- Landwirtschaft: Wird in der Landwirtschaft als Bodenverbesserungsmittel verwendet, um den pH-Wert des Bodens anzupassen und Pflanzen mit wichtigen Nährstoffen zu versorgen.
- Chemische Industrie: Wird bei der Herstellung von Chemikalien wie Calciumcarbid, Calciumhypochlorit und Calciumstearat verwendet.
- Bauwesen: Wird in der Bauindustrie als Bestandteil von Zement, Mörtel und Putz verwendet.
- Lebensmittelindustrie: Wird in der Lebensmittelindustrie als Festigungsmittel und Säureregulator verwendet.
- Papierindustrie: Wird in der Papierindustrie als Bestandteil der Weißlauge im Kraftzellstoffprozess verwendet.
- Erdölindustrie: Wird in der Erdölindustrie als Katalysator im Raffinierungsprozess verwendet.
Fragen:
F: Wie lautet die Formel für Calciumoxid?
A: Die Formel für Calciumoxid ist CaO.
F: Wie hoch ist die Oxidationszahl von Kalzium?
A: Die Oxidationszahl von Calcium in Calciumoxid beträgt +2.
F: Ist Calciumoxid ionisch oder kovalent?
A: Calciumoxid ist eine ionische Verbindung, die aus positiv geladenen Calciumionen und negativ geladenen Oxidionen besteht.
F: Ist Calciumoxid ein Feststoff?
A: Ja, Calciumoxid ist bei normaler Raumtemperatur und normalem Druck ein Feststoff. Es hat ein weißes oder grauweißes Aussehen und ist sehr reaktiv.
