Bortrichlorid (BCl3) ist eine Verbindung, die aus drei Chloratomen besteht, die an ein Boratom gebunden sind. Es wird in verschiedenen industriellen Prozessen verwendet, beispielsweise als Katalysatoren und als Reagenz in der organischen Synthese.
| IUPAC-Name | Bortrichlorid |
| Molekularformel | BCl3 |
| CAS-Nummer | 10294-34-5 |
| Synonyme | Trichlorboran; Bor(III)-chlorid, Trichlorboran, Trichlorbor |
| InChI | InChI=1S/BCl3/c2-1(3)4 |
Eigenschaften von Bortrichlorid
Bortrichlorid-Formel
Die Formel für Borchlorid lautet BCl3 und steht für ein Boratom, das an drei Chloratome gebunden ist. Dies ist eine einfache und unkomplizierte Summenformel, die die Zusammensetzung dieser Verbindung beschreibt.
Molmasse von Bortrichlorid
Die Molmasse von Borchlorid kann durch Addition der Atommassen seiner Bestandteile berechnet werden. Bor hat eine Atommasse von etwa 10,81 Gramm pro Mol und jedes Chloratom hat eine Atommasse von etwa 35,45 Gramm pro Mol. Daher beträgt die Molmasse von BCl3 etwa 117,17 Gramm pro Mol.
Siedepunkt von Bortrichlorid
Borchlorid hat im Vergleich zu vielen anderen Verbindungen einen relativ niedrigen Siedepunkt. Es siedet bei etwa -15,7 Grad Celsius oder 3,77 Grad Fahrenheit. Das bedeutet, dass Borchlorid bei Temperaturen oberhalb dieses Punktes von der flüssigen Phase in die gasförmige Phase übergeht.
Bortrichlorid Schmelzpunkt
Der Schmelzpunkt von Borchlorid ist relativ niedrig. Es schmilzt bei etwa -107,5 Grad Celsius oder -161,5 Grad Fahrenheit. Bei Temperaturen unterhalb dieses Punktes geht die Verbindung vom festen in den flüssigen Zustand über.
Dichte von Bortrichlorid g/ml
Die Dichte von Borchlorid beträgt etwa 1,38 Gramm pro Milliliter. Dieser Wert gibt die Masse der Verbindung pro Volumeneinheit an. Es ist nützlich, um das Verhalten von Borchlorid in verschiedenen Anwendungen zu bestimmen und seine physikalischen Eigenschaften zu verstehen.
Molekulargewicht von Bortrichlorid
Das Molekulargewicht von Borchlorid beträgt etwa 117,17 Gramm pro Mol. Dieser Wert stellt die Summe der Atommassen aller Atome in einem Molekül der Verbindung dar und ist für verschiedene Berechnungen nützlich, beispielsweise zur Bestimmung der Menge an Borchlorid in einer bestimmten Probe.
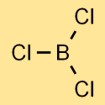
Struktur von Bortrichlorid
Borchlorid hat eine trigonal-planare Molekülstruktur. Es besteht aus einem Boratom in der Mitte, an das drei dreieckig angeordnete Chloratome gebunden sind. Diese Struktur trägt zu den physikalischen und chemischen Eigenschaften der Verbindung bei.
Löslichkeit von Bortrichlorid
Borchlorid hat eine geringe Wasserlöslichkeit. Es ist schwer löslich, das heißt, es löst sich in wässrigen Lösungen nur bedingt. In organischen Lösungsmitteln wie Benzol und Tetrachlorkohlenstoff ist es jedoch besser löslich. Die Löslichkeit von Borchlorid beeinflusst sein Verhalten bei verschiedenen chemischen Reaktionen und industriellen Prozessen.
| Aussehen | Farbloses Gas |
| Spezifisches Gewicht | 1.369 g/ml |
| Farbe | Farblos |
| Geruch | Acre |
| Molmasse | 117,17 g/Mol |
| Dichte | 1,38 g/ml |
| Fusionspunkt | -107,5°C |
| Siedepunkt | -15,7°C |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Reagiert |
| Löslichkeit | Löslich in organischen Lösungsmitteln wie Benzol und Tetrachlorkohlenstoff |
| Dampfdruck | 623 mmHg bei 20°C |
| Wasserdampfdichte | 3,24 (Luft = 1) |
| pKa | Unzutreffend |
| pH-Wert | Unzutreffend |
Sicherheit und Gefahren von Bortrichlorid
Borchlorid wirft mehrere Sicherheits- und Gefahrenaspekte auf. Es ist ätzend und kann bei Kontakt schwere Verätzungen der Haut, Augen und Atemwege verursachen. Das Einatmen der Dämpfe kann zu Reizungen der Atemwege und Lungenschäden führen. Die Verbindung reagiert auch sehr reaktiv mit Wasser und setzt giftiges Chlorwasserstoffgas frei. Es ist wichtig, mit Borchlorid vorsichtig umzugehen, geeignete persönliche Schutzausrüstung zu verwenden und für ausreichende Belüftung zu sorgen. Im Falle einer versehentlichen Exposition ist sofortige ärztliche Hilfe erforderlich. Darüber hinaus müssen ordnungsgemäße Lagerungs- und Handhabungsverfahren befolgt werden, um die Gefahr von Bränden, Explosionen und der Freisetzung gefährlicher Gase zu vermeiden.
| Gefahrensymbole | Ätzend (C) |
| Sicherheitsbeschreibung | Schutzhandschuhe/Augenschutz/Gesichtsschutz tragen. Staub/Rauch/Gas/Nebel/Dampf/Aerosol nicht einatmen. In einem gut belüfteten Bereich handhaben. |
| UN-Identifikationsnummern | UN1741 |
| HS-Code | 2827390000 |
| Gefahrenklasse | 8 (Ätzende Stoffe) |
| Verpackungsgruppe | II |
| Toxizität | Sehr giftig beim Verschlucken oder Einatmen. Kann schwere Verbrennungen und Reizungen der Atemwege verursachen. Mit äußerster Vorsicht umgehen. |
Methoden zur Synthese von Bortrichlorid
Eine Methode zur Synthese von Borchlorid beinhaltet die Reaktion zwischen Boroxid (B2O3 ) und Tetrachlorkohlenstoff (CCl4) in Gegenwart eines Katalysators wie Aluminiumchlorid (AlCl3) . B2O3 und CCl4 reagieren bei hohen Temperaturen und erzeugen als Nebenprodukte Borchlorid und Kohlendioxid.
Ein anderer Ansatz ist die direkte Reaktion zwischen Bor und Chlorgas. Unter kontrollierten Bedingungen reagiert Bor mit Chlor, was zur Bildung von Borchlorid führt. Aufgrund seiner Gefährlichkeit erfordert diese Methode einen sorgfältigen Umgang mit Chlorgas.
Thionylchlorid (SOCl2) ermöglicht die Synthese von Borchlorid durch Reaktion von Bor mit SOCl2 bei erhöhten Temperaturen, was zur Bildung von Borchlorid und Schwefeldioxidgas führt.
Diese Synthesemethoden bieten praktikable Wege für die Herstellung von Borchlorid, sowohl im Labor als auch in industriellen Umgebungen. Es ist von entscheidender Bedeutung, während der Synthese angemessene Sicherheitsmaßnahmen zu gewährleisten, z. B. das Arbeiten in gut belüfteten Bereichen und die Verwendung geeigneter Schutzausrüstung. Dies ist wichtig, da die am Prozess beteiligten Reagenzien und Produkte gefährlich sind.
Beschreiben Sie die Verwendung von Bortrichlorid
Borchlorid wird aufgrund seiner einzigartigen chemischen Eigenschaften und Vielseitigkeit häufig in der Katalyse, der Halbleiterherstellung, der Materialsynthese und verschiedenen anderen Branchen eingesetzt.
- Borchlorid (BCl3) findet als Katalysator in verschiedenen chemischen Reaktionen Anwendung, insbesondere in der organischen Synthese. Es erleichtert die Bildung von Kohlenstoff-Kohlenstoff- und Kohlenstoff-Heteroatom-Bindungen bei der Herstellung von Pharmazeutika, Agrochemikalien und Feinchemikalien.
- BCl3 dient als Reagens bei der Synthese von borbasierten Polymeren wie Polyborazylen, die in flammhemmenden und Hochtemperaturbeschichtungen Anwendung finden.
- BCl3 erleichtert die Herstellung von Bornitrid, einem Material, das für seine außergewöhnliche thermische und chemische Stabilität bekannt ist und häufig in Hochtemperaturanwendungen und als Schmiermittel eingesetzt wird.
- Die Halbleiterindustrie verwendet BCl3 als Dotierstoff, um Boratome in Siliziumkristalle einzubauen, deren elektrische Eigenschaften zu verbessern und sie für den Einsatz in elektronischen Geräten geeignet zu machen.
- In der Metallurgie dient BCl3 als Flussmittel, um oxidische Verunreinigungen beim Raffinieren von Metallen zu entfernen und so deren Reinheit zu verbessern.
- BCl3 spielt eine zentrale Rolle bei der Herstellung von Borcarbid, einem leichten und starken Material, das häufig bei der Herstellung von Keramikpanzerungen und Schneidwerkzeugen verwendet wird.
- BCl3 spielt eine entscheidende Rolle bei der Synthese vieler borhaltiger Verbindungen, darunter Borester, Boronsäuren und Borane. Diese Verbindungen finden zahlreiche Anwendungen in der chemischen Forschung und in industriellen Prozessen.
- In der Erdölindustrie wird BCl3 als Zusatz zur Erhöhung der Oktanzahl von Benzin verwendet.
Es dient als Borquelle bei der Herstellung von borhaltigem Glas, das wünschenswerte optische und thermische Eigenschaften aufweist.
Fragen:
F: Wie lautet die Formel für Bortrichlorid?
A: Die Formel für Borchlorid lautet BCl3.
F: Ist Bortrichlorid polar?
A: Ja, Borchlorid ist aufgrund des Vorhandenseins eines freien Dubletts am Boratom und der asymmetrischen Anordnung der Chloratome ein polares Molekül.
F: Was ist Borhybridisierung in Bortrichlorid (BCl3)?
A: Die Hybridisierung von Bor in BCl3 ist sp2.
F: Wie groß ist die Masse eines Bortrichloridmoleküls?
A: Die Masse eines Moleküls Borchlorid (BCl3) beträgt etwa 117,17 Gramm pro Mol.
F: Was ist Bortrichlorid-Hybridisierung?
A: Die Hybridisierung von Bor in Borchlorid (BCl3) ist sp2.
F: Was passiert, wenn man Bortrichlorid und Wasserstoff mischt?
A: Wenn Borchlorid (BCl3) mit Wasserstoff (H2) gemischt wird, reagieren sie unter Bildung von Bor und Chlorwasserstoffgas (HCl).
F: Warum liegt Bortrichlorid als Monomer vor, während Aluminiumtrichlorid als Dimer vorliegt?
A: Der Unterschied in Größe und Elektronendichte zwischen Bor- und Aluminiumatomen führt dazu, dass Borchlorid (BCl3) als Monomer vorliegt, während Aluminiumchlorid (AlCl3) aufgrund seiner Fähigkeit, koordinative Bindungen zu bilden, ein Dimer bildet.
F: Ist BCl3 eine Lewis-Säure?
A: Ja, BCl3 ist eine Lewis-Säure, da sie ein Elektronenpaar von einer Lewis-Base aufnehmen kann.
F: Ist BCl3 ionisch oder kovalent?
A: BCl3 ist eine kovalente Verbindung.
F: Ist BCl3 eine kovalente Bindung?
A: Ja, BCl3 besteht aus kovalenten Bindungen zwischen Bor- und Chloratomen.
F: Ist BCl3 ein Gas?
A: Ja, BCl3 ist ein Gas mit Standardtemperatur und -druck (STP).
F: Ist BCl3 ein polares oder unpolares Molekül?
A: BCl3 ist aufgrund der ungleichmäßigen Verteilung der Elektronendichte, die durch die asymmetrische Anordnung der Chloratome um das Boratom verursacht wird, ein polares Molekül.
