Bariumhydroxid ist eine chemische Verbindung mit der Formel Ba(OH)2. Es ist ein weißer kristalliner Feststoff, der gut wasserlöslich ist und häufig in Labors und industriellen Prozessen verwendet wird.
| IUPAC-Name | Bariumdihydroxid |
| Molekularformel | Ba(OH)2 |
| CAS-Nummer | 17194-00-2 |
| Synonyme | Barium(II)-hydroxid, Baryt, Bariumhydrat, Bariumdihydrat, Bis(bariumhydroxid), Bis(oxydanyl)bariumhydrat |
| InChI | InChI=1S/Ba.2H2O/h;2*1H2/q+2;;/p-2 |
Molmasse von Bariumhydroxid
Bariumhydroxid hat eine Molmasse von 171,34 g/mol. Es besteht aus einem Bariumion (Ba2+) und zwei Hydroxidionen (OH-), die jeweils eine Molmasse von 137,33 g/mol bzw. 17,01 g/mol haben. Die Molmasse von Bariumhydroxid ist wichtig für die Bestimmung der Menge einer Verbindung, die für Reaktionen benötigt wird, oder für die Berechnung der Konzentration einer Lösung.
Bariumhydroxid-Formel
Die chemische Formel für Bariumhydroxid lautet Ba(OH)2. Es besteht aus einem Bariumion (Ba2+) und zwei Hydroxidionen (OH-). Die Bariumhydroxidformel ist wichtig, um die Menge einer Verbindung zu bestimmen, die in Reaktionen benötigt wird, oder um die Konzentration einer Lösung zu berechnen. Es wird auch verwendet, um die Struktur der Verbindung und ihr Verhalten in Lösung darzustellen.
Siedepunkt von Ba(OH)2
Der Siedepunkt von Ba(OH)2 ist nicht genau definiert, da es sich vor dem Sieden zersetzt. Ba(OH)2 ist eine starke Base und reagiert leicht mit Kohlendioxid in der Luft unter Bildung von Bariumcarbonat und Wasser. Die Zersetzungstemperatur von Ba(OH)2 hängt von der Konzentration der Lösung ab, liegt aber im Allgemeinen über 780 °C.
Ba(OH)2 Schmelzpunkt
Ba(OH)2 hat einen Schmelzpunkt von 407°C. Es liegt in festem Zustand in Form weißer, geruchloser Kristalle vor. Beim Erhitzen geht Ba(OH)2 eine reversible Reaktion unter Bildung von Bariumoxid und Wasser ein. Der Schmelzpunkt von Ba(OH)2 ist wichtig für die Bestimmung der Temperatur, bei der es sicher gehandhabt und gelagert werden kann.
Ba(OH)2-Dichte g/ml
Die Dichte des festen Ba(OH)2 beträgt 3,22 g/cm3. In Lösung variiert die Dichte je nach Konzentration. Beispielsweise hat eine 10 %ige Lösung von Ba(OH)2 eine Dichte von 1,17 g/cm3. Die Dichte von Ba(OH)2 ist wichtig bei der Bestimmung des Volumens einer Lösung, das für Reaktionen oder beim Umgang mit der Verbindung benötigt wird.
Molekulargewicht von Ba(OH)2
Das Molekulargewicht von Ba(OH)2 beträgt 171,34 g/mol. Es ist die Summe der Atomgewichte eines Bariumions und zweier Hydroxidionen. Das Molekulargewicht von Ba(OH)2 ist wichtig für die Bestimmung der in Reaktionen benötigten Verbindungsmenge oder für die Berechnung der Konzentration einer Lösung.
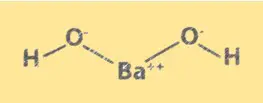
Struktur Ba(OH)2
Ba(OH)2 hat eine ähnliche Kristallstruktur wie Natriumchlorid. Es besteht aus Ba2+-Ionen und OH–Ionen, die in einem kubischen Gitter angeordnet sind. Die Ba2+-Ionen besetzen die Ecken des Würfels und die OH–Ionen besetzen die Mitte jeder Fläche. Die Struktur von Ba(OH)2 ist wichtig für das Verständnis seiner chemischen Eigenschaften und seines Verhaltens in Lösung.
| Aussehen | Weißer kristalliner Feststoff |
| Spezifisches Gewicht | 3,22 g/cm3 (fest) |
| Farbe | Weiß |
| Geruch | Geruchlos |
| Molmasse | 171,34 g/Mol |
| Dichte | 2,18 g/cm3 (wässrige Lösung, 10 % w/w bei 25 °C) |
| Fusionspunkt | 407°C |
| Siedepunkt | Zerfällt vor dem Kochen |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Sehr gut wasserlöslich |
| Löslichkeit | Löslich in Alkohol und Aceton |
| Dampfdruck | Unerheblich |
| Wasserdampfdichte | Unzutreffend |
| pKa | Unzutreffend |
| pH-Wert | Alkalisch (pH > 7) |
Hinweis: Die in dieser Tabelle angegebenen Werte sind allgemeine Beschreibungen und können je nach spezifischen Bedingungen und Konzentrationen des Stoffes variieren.
Sicherheit und Gefahren von Bariumhydroxid
Ba(OH)2 ist eine stark ätzende und giftige Substanz, die schwere Reizungen der Haut, Augen und Atemwege verursachen kann. Es ist wichtig, vorsichtig damit umzugehen und geeignete persönliche Schutzausrüstung wie Handschuhe und Schutzbrille zu tragen. Beim Einatmen oder Verschlucken kann es zu schweren Schäden an Lunge, Verdauungssystem und Nieren kommen. Es sollte an einem kühlen, trockenen und gut belüfteten Ort gelagert werden, entfernt von inkompatiblen Materialien wie Säuren und Oxidationsmitteln. Befolgen Sie im Falle einer Verschüttung oder Exposition die entsprechenden Notfallmaßnahmen, z. B. die Evakuierung des Bereichs und die sofortige Suche nach ärztlicher Hilfe.
| Gefahrensymbole | Ätzend |
| Sicherheitsbeschreibung | Kontakt mit Haut und Augen vermeiden; Schutzkleidung und Handschuhe tragen; Nur in gut belüfteten Bereichen verwenden |
| AN-Kennungen | UN 1564 |
| HS-Code | 2816.40.00 |
| Gefahrenklasse | 8 |
| Verpackungsgruppe | II |
| Toxizität | Giftig beim Verschlucken, Einatmen und Hautabsorption; Verursacht schwere Haut- und Augenreizungen; Kann Reizungen der Atemwege und Nierenschäden verursachen |
Methoden zur Synthese von Bariumhydroxid
Ba(OH)2 kann durch verschiedene Methoden synthetisiert werden, einschließlich der Reaktion von Bariumoxid (BaO) mit Wasser (H2O) oder der Reaktion von Bariumchlorid (BaCl2) mit Natriumhydroxid (NaOH).
Bei der ersten Methode wird Bariumoxid unter ständigem Rühren langsam zu destilliertem Wasser gegeben, bis die gewünschte Konzentration erreicht ist. Die resultierende Lösung wird dann filtriert und getrocknet, um die feste Form von Ba(OH)2 zu erhalten.
Bei der zweiten Methode wird eine Bariumchloridlösung langsam unter ständigem Rühren zu einer Natriumhydroxidlösung gegeben, bis der gewünschte pH-Wert erreicht ist. Die resultierende Lösung wird dann filtriert und getrocknet, um die feste Form von Ba(OH)2 zu erhalten.
Eine andere Methode beinhaltet die Reaktion von Bariumsulfid (BaS) mit Wasser, wobei Ba(OH)2 und Schwefelwasserstoffgas (H2S) entstehen.
Ba(OH)2 kann auch durch Elektrolyse geschmolzener Bariumsalze oder durch thermische Zersetzung von Bariumcarbonat (BaCO3) bei hoher Temperatur hergestellt werden.
Insgesamt erfordert die Synthese von Ba(OH)2 aufgrund seiner stark ätzenden und toxischen Eigenschaften eine sorgfältige Handhabung und entsprechende Sicherheitsvorkehrungen. Bei der Arbeit mit Gefahrstoffen ist es wichtig, die entsprechenden Sicherheitsprotokolle und -vorschriften zu befolgen.
Verwendung von Bariumhydroxid
Aufgrund seiner hochreaktiven Natur und alkalischen Eigenschaften findet Ba(OH)2 zahlreiche Anwendungen in Industrie und Labor. Eine seiner Hauptanwendungen ist die Verwendung als chemisches Reagenz bei der Herstellung verschiedener Chemikalien, darunter Schmierstoffe, Kunststoffe und Pestizide.
Ba(OH)2 wird auch als Stabilisator in PVC und anderen Kunststoffen verwendet, um Verfärbungen und Zersetzung durch Hitze und UV-Strahlung zu verhindern. Es wird auch bei der Herstellung bestimmter Glasarten verwendet, beispielsweise optisches Glas und Glas mit hohem Brechungsindex.
Im Labor wird Ba(OH)2 als Katalysator in verschiedenen organischen Reaktionen verwendet, beispielsweise bei Veresterungs- und Umesterungsreaktionen. Es wird auch als Titriermittel in der analytischen Chemie zur Bestimmung schwacher Säuren und zur Herstellung von Standardlösungen verwendet.
Eine weitere Anwendung von Ba(OH)2 ist die Herstellung von Bariumoxid, das bei der Herstellung von Kathodenstrahlröhren für Fernseher und Computermonitore verwendet wird.
Ba(OH)2 wird auch bei der Behandlung von Industrieabwässern verwendet, um Verunreinigungen zu entfernen und saure oder alkalische Abwässer vor der Einleitung in die Umwelt zu neutralisieren.
Insgesamt spielt Ba(OH)2 in vielen Branchen und Laboren eine wesentliche Rolle und trägt zur Herstellung vieler Produkte und Prozesse bei.
Fragen:
Ist Bariumhydroxid löslich?
Ja, Bariumhydroxid ist wasserlöslich. In Wasser gelöst bildet es eine alkalische Lösung mit einem pH-Wert von etwa 12,5. Die Löslichkeit von Ba(OH)2 in Wasser ist relativ hoch, mit einer Löslichkeit von etwa 3,52 g/100 ml bei Raumtemperatur (25 °C). Die Löslichkeit von Ba(OH)2 kann durch Faktoren wie Temperatur, Druck und das Vorhandensein anderer Substanzen in der Lösung beeinflusst werden.
Ist Bariumhydroxid eine starke Base?
Ja, Bariumhydroxid ist eine starke Base. Wenn es in Wasser gelöst wird, dissoziiert es vollständig und bildet in der Lösung Bariumionen (Ba2+) und Hydroxidionen (OH-). Durch diese Dissoziation entsteht eine stark alkalische Lösung mit einem pH-Wert von etwa 12,5. Die starken basischen Eigenschaften von Ba(OH)2 machen es zu einem wirksamen Neutralisator saurer Abwässer und zu einem Katalysator bei verschiedenen organischen Reaktionen.
Wie lautet die Formel für Bariumhydroxid?
Die Formel für Bariumhydroxid lautet Ba(OH)2. Diese Formel gibt an, dass jedes Bariumhydroxidmolekül ein Bariumion (Ba2+) und zwei Hydroxidionen (OH-) enthält. Das Bariumion hat eine Ladung von +2, während das Hydroxidion eine Ladung von -1 hat. Die beiden Hydroxidionen in Ba(OH)2 gleichen die Ladung +2 des Bariumions aus und bilden eine neutrale Verbindung. Die Formel von Ba(OH)2 ist wichtig für das Verständnis seiner Eigenschaften und Reaktionen sowie für die Berechnung seiner Molmasse und anderer physikalisch-chemischer Eigenschaften.
