Bariumchlorid-Dihydrat ist eine weiße kristalline Verbindung mit der chemischen Formel BaCl2·2H2O. Es wird häufig im Labor als Reagenz und in der Industrie zur Behandlung von Metalloberflächen verwendet.
| IUPAC-Name | Bariumchlorid-Dihydrat |
| Molekularformel | BaCl2·2H2O |
| CAS-Nummer | 10326-27-9 |
| Synonyme | Bariumdichlorid-Dihydrat; Barium(II)-chlorid-Dihydrat; Hydratisiertes Bariumchlorid (1:2:2); Bariumchlorid-2-hydrat; Bariumchlorid-Dihydrat; Bariumdichlorid, Dihydrat; Barium(2+)chlorid-Dihydrat |
| InChI | InChI=1S/Ba.2ClH.2H2O/h;21H;21H2/q+2;;;/p-2 |
Molmasse von BaCl2·2H2O
Die Molmasse von Bariumchlorid-Dihydrat (BaCl2·2H2O) beträgt 244,26 g/mol. Dieser Wert kann berechnet werden, indem die Atommassen jedes in der Verbindung vorhandenen Elements addiert werden. Barium hat eine Molmasse von 137,33 g/mol, Chlor hat eine Molmasse von 35,45 g/mol und Wasserstoff und Sauerstoff haben Molmassen von 1,01 g/mol bzw. 16,00 g/mol. Die beiden Wassermoleküle addieren weitere 36,02 g/mol. Die Molmasse von BaCl2·2H2O ist wichtig für stöchiometrische Berechnungen, bei denen die Menge des Reaktanten oder Produkts in Mol ausgedrückt wird.
Bariumchlorid-Dihydrat-Formel
Die chemische Formel für Bariumchlorid-Dihydrat lautet BaCl2·2H2O. Diese Formel gibt an, dass jede Formeleinheit der Verbindung ein Bariumion, zwei Chloridionen und zwei Wassermoleküle enthält. Die Formel ist wichtig für stöchiometrische Berechnungen und zum Verständnis der chemischen und physikalischen Eigenschaften der Verbindung.
Siedepunkt von Bariumchlorid-Dihydrat
BaCl2·2H2O hat einen Siedepunkt von 1560°C. Bei dieser Temperatur vollzieht die Verbindung einen Phasenübergang von flüssig zu gasförmig. Der hohe Siedepunkt ist auf die ionische Natur der Verbindung zurückzuführen, die eine große Energiemenge erfordert, um die starken elektrostatischen Kräfte aufzubrechen, die die Ionen zusammenhalten. Aufgrund seiner hohen Schmelz- und Siedepunkte wird BaCl2 · 2H2O in der Industrie als Wärmebehandlungsmittel für Metalloberflächen eingesetzt.
Schmelzpunkt von Bariumchlorid-Dihydrat
Der Schmelzpunkt von BaCl2 · 2H2O beträgt 962 °C. Bei dieser Temperatur geht die Verbindung vom Feststoff in den flüssigen Zustand über. Der hohe Schmelzpunkt von BaCl2·2H2O ist auf die starken Ionenbindungen zwischen Barium- und Chlorionen sowie auf Wasserstoffbrückenbindungen zwischen Wassermolekülen zurückzuführen. Der Schmelzpunkt von BaCl2·2H2O ist eine wichtige Eigenschaft für seine Verwendung in verschiedenen Anwendungen wie der Herstellung von Pigmenten und Farbstoffen und der Behandlung von Metalloberflächen.
Dichte von Bariumchlorid-Dihydrat g/ml
Die Dichte von Bariumchlorid-Dihydrat beträgt 3,097 g/cm³. Das bedeutet, dass 1 cm³ Bariumchlorid-Dihydrat 3,097 Gramm wiegt. Die Dichte eines Stoffes ist eine wichtige Eigenschaft, die Aufschluss über seine physikalischen und chemischen Eigenschaften geben kann. Im Fall von Bariumchlorid-Dihydrat ist die hohe Dichte auf die relativ große Atommasse des Bariums und die dichte Packung der Ionen in der Kristallgitterstruktur zurückzuführen.
BaCl2 · 2H2O Molekulargewicht
Das Molekulargewicht von BaCl2·2H2O beträgt 244,26 g/mol. Dieser Wert kann durch Addition der Atomgewichte jedes in der Verbindung vorhandenen Elements berechnet werden. Das Molekulargewicht ist eine wichtige Eigenschaft von BaCl2 · 2H2O, da es in verschiedenen Anwendungen wie der Herstellung von Pigmenten und Farbstoffen sowie als Reagenz in Laborexperimenten verwendet wird.
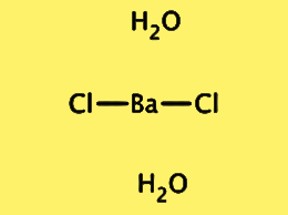
Struktur BaCl2·2H2O
Die Kristallstruktur von BaCl2·2H2O ist orthorhombisch mit der Raumgruppe Pnma. Die Elementarzelle enthält eine Einheit mit der Formel BaCl2·2H2O, bestehend aus einem Bariumion, zwei Chloridionen und zwei Wassermolekülen. Das Bariumion ist von acht Chloridionen umgeben und die Wassermoleküle sind über Wasserstoffbrücken an die Chloridionen gebunden. Die Kristallstruktur von BaCl2 · 2H2O ist wichtig für das Verständnis seiner physikalischen und chemischen Eigenschaften sowie für seine Verwendung in verschiedenen Anwendungen.
| Aussehen | Weißer kristalliner Feststoff |
| Spezifisches Gewicht | 3,097 g/cm³ |
| Farbe | Farblos bis weiß |
| Geruch | Geruchlos |
| Molmasse | 244,26 g/Mol |
| Dichte | 3,097 g/cm³ |
| Fusionspunkt | 962°C |
| Siedepunkt | 1560°C |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | 31,2 g/100 ml (bei 20 °C) |
| Löslichkeit | Löslich in Alkohol und Aceton |
| Dampfdruck | Unzutreffend |
| Wasserdampfdichte | Unzutreffend |
| pKa | Unzutreffend |
| pH-Wert | Neutral (7) |
Hinweis: Abhängig von den Anzeigeeinstellungen der Plattform oder des verwendeten Geräts ist die Tabelle möglicherweise nicht richtig ausgerichtet.
Sicherheit und Gefahren von Bariumchlorid-Dihydrat
BaCl2 · 2H2O birgt mehrere Sicherheits- und Gesundheitsrisiken, die bei unsachgemäßer Handhabung schädlich sein können. Es handelt sich um eine ätzende Substanz, die bei Kontakt schwere Verätzungen der Haut und der Augen verursachen kann. Das Einatmen von Staub oder Dämpfen kann Atemprobleme und Lungenschäden verursachen. Außerdem ist es bei Einnahme giftig und kann Magen-Darm-Probleme verursachen. BaCl2 · 2H2O sollte mit Vorsicht gehandhabt werden und bei der Arbeit mit der Verbindung sollte geeignete Schutzausrüstung wie Handschuhe, Schutzbrillen und Atemschutzmasken getragen werden. Es sollte entfernt von unverträglichen Substanzen und an einem sicheren Ort gelagert werden, um eine versehentliche Exposition zu verhindern. Suchen Sie im Notfall sofort einen Arzt auf.
| Gefahrensymbole | Ätzend (C) | |
| Sicherheitsbeschreibung | ||
| AN-Kennungen | UN1564 | |
| HS-Code | 28273990 | |
| Gefahrenklasse | 8 | |
| Verpackungsgruppe | III | |
| Toxizität | Giftig beim Verschlucken; kann Magen-Darm-Probleme verursachen. Ätzend für Haut und Augen. Das Einatmen von Staub oder Dämpfen kann Atemprobleme und Lungenschäden verursachen. | |
Methoden zur Synthese von Bariumchlorid-Dihydrat
Sie können BaCl2 · 2H2O auf verschiedene Arten synthetisieren.
Eine übliche Methode ist die Reaktion von Bariumcarbonat oder Bariumhydroxid mit Salzsäure. Sie müssen die resultierende Lösung verdampfen, um die feste Verbindung zu erhalten.
Eine andere Methode besteht darin, Bariumsulfid mit Salzsäure umzusetzen. Bei dieser Reaktion entsteht Schwefelwasserstoffgas, das ordnungsgemäß entsorgt werden muss. Die erhaltene Lösung wird dann durch Filtration und Kristallisation gereinigt, um das Endprodukt zu erhalten.
Sie können BaCl2 · 2H2O auch durch eine Fällungsreaktion mit Natriumchlorid und Bariumnitrat synthetisieren. Sie müssen die beiden Verbindungen in einer Lösung mischen, dann den resultierenden Niederschlag filtrieren und trocknen, um die feste Verbindung zu erhalten.
Darüber hinaus kann BaCl2 · 2H2O durch die Reaktion von Bariumoxid mit Salzsäure synthetisiert werden. Bei dieser Reaktion entsteht als Nebenprodukt Wasser, das Sie durch Verdunstung entfernen müssen. Die erhaltene Lösung wird dann kristallisiert, um das Endprodukt zu erhalten.
Bei der Arbeit mit BaCl2 · 2H2O müssen Sie entsprechende Sicherheitsvorkehrungen treffen, da es sich um eine ätzende und giftige Verbindung handelt. Sie sollten Schutzausrüstung wie Handschuhe, Schutzbrille und Atemschutzmasken tragen und die Verbindung in einem gut belüfteten Bereich handhaben.
Verwendungsmöglichkeiten von Bariumchlorid-Dihydrat
BaCl2 · 2H2O wird in verschiedenen Branchen vielfältig eingesetzt.
- Die chemische Industrie verwendet BaCl2 · 2H2O als Reagens bei verschiedenen chemischen Reaktionen, beispielsweise bei der Herstellung von Bariumsalzen, Pigmenten und Keramik.
- Es fungiert als Flussmittel bei der Metallraffinierung und als Katalysator bei der organischen Synthese.
- Die medizinische Industrie verwendet BaCl2 · 2H2O als Kontrastmittel in der Radiographie und zur Behandlung von Bariumvergiftungen. Es wird auch bei der Herstellung von Zahnzementen verwendet.
- Die Textilindustrie verwendet BaCl2 · 2H2O als Beizmittel, eine Substanz, die Farbstoffe an Fasern bindet, und als Flammschutzmittel für Textilien.
- In der Erdölindustrie wird BaCl2 · 2H2O als Zusatz zu Bohrschlamm verwendet, um die Schlammdichte zu erhöhen und Ausbrüche während Bohrarbeiten zu verhindern.
- Die Lebensmittelindustrie verwendet BaCl2 · 2H2O als Konservierungsmittel und Geschmacksverstärker für bestimmte Lebensmittel.
Um die mit der Arbeit mit dem ätzenden und giftigen BaCl2 · 2H2O verbundenen Risiken zu minimieren, sollten geeignete Sicherheitsvorkehrungen getroffen werden, wie das Tragen von Schutzausrüstung und die Handhabung der Verbindung in einem gut belüfteten Bereich.
Fragen:
Wie lautet die Formel für Bariumchlorid-Dihydrat?
Die Formel für Bariumchlorid-Dihydrat lautet BaCl2·2H2O.
Ist Bariumchlorid-Dihydrat wasserlöslich?
Ja, Bariumchlorid-Dihydrat ist gut wasserlöslich. Es löst sich leicht in Wasser mit einer Löslichkeit von etwa 31,2 g/100 ml bei Raumtemperatur. Diese hohe Löslichkeit macht es zu einer nützlichen Verbindung in verschiedenen Branchen, beispielsweise bei der Herstellung von Bariumsalzen und als Bohrschlammzusatz in der Erdölindustrie. Seine hohe Löslichkeit bedeutet jedoch auch, dass es bei unsachgemäßer Handhabung eine Gefahr für die menschliche Gesundheit und die Umwelt darstellen kann, da es Wasserquellen verunreinigen und für Wasserorganismen giftig sein kann. Daher sollten bei der Arbeit mit BaCl2 · 2H2O entsprechende Vorsichtsmaßnahmen getroffen werden, um eine Kontamination zu vermeiden und eine sichere Handhabung zu gewährleisten.
