Ammoniumsulfat ((NH4)2SO4) ist ein weit verbreiteter Dünger, der Pflanzen mit wichtigen Nährstoffen versorgt. Es wird auch in Flammschutzmitteln, zur Proteinreinigung und als Lebensmittelzusatzstoff verwendet.
| Name der IUPAC | Ammoniumtetraoxosulfat (VI) |
| Molekularformel | (NH4)2SO4 |
| CAS-Nummer | 7783-20-2 |
| Synonyme | Ammoniumsulfat, Ammoniumsulfat (2:1), Diammoniumsulfat, Diammoniumsalz der Schwefelsäure, Mascagnit, Actamaster, Dolamin |
| InChI | InChI=1S/2H3N.H2O4S/c;;1-5(2,3)4/h2*1H3;(H2,1,2,3,4) |
Eigenschaften von Ammoniumsulfat
Ammoniumsulfat-Formel
Die Formel für Ammoniumsulfat lautet (NH4)2SO4. Das bedeutet, dass ein Molekül Ammoniumsulfat zwei Ammoniumionen (NH4)+ und ein Sulfation (SO4)2- enthält. Die Ammoniumionen und das Sulfation werden durch ionische Bindungen zusammengehalten.
Ammoniumsulfat-Molmasse
Die Molmasse von (NH4)2SO4 beträgt 132,14 g/mol. Um die Molmasse zu berechnen, müssen wir die Atommassen aller Atome in der Formel addieren. Die Atommassen sind:
- Stickstoff: 14,01 g/mol
- Wasserstoff: 1,01 g/mol
- Schwefel: 32,06 g/mol
- Sauerstoff: 16,00 g/mol
Somit beträgt die Molmasse von (NH4)2SO4:
(2 x 14,01) + (8 x 1,01) + 32,06 + (4 x 16,00) = 132,14 g/mol
Siedepunkt von Ammoniumsulfat
Der Siedepunkt von (NH4)2SO4 ist nicht genau definiert, da es sich vor Erreichen des Siedepunkts zersetzt. Beim Erhitzen über 235 °C beginnt (NH4)2SO4 Wasser zu verlieren und Ammoniumbisulfat (NH4)HSO4 zu bilden. Beim Erhitzen über 280 °C zerfällt Ammoniumbisulfat weiter in Ammoniak (NH3) und Schwefelsäure (H2SO4).
Ammoniumsulfat Schmelzpunkt
Der Schmelzpunkt von (NH4)2SO4 beträgt 235°C. Dies ist die Temperatur, bei der (NH4)2SO4 vom festen in den flüssigen Zustand übergeht. Wie oben erwähnt beginnt sich jedoch auch (NH4)2SO4 bei dieser Temperatur zu zersetzen, es handelt sich also nicht um eine reine flüssige Phase.
Dichte von Ammoniumsulfat g/ml
Die Dichte von (NH4)2SO4 beträgt 1,77 g/ml bei Raumtemperatur und Druck. Das bedeutet, dass ein Milliliter (NH4)2SO4 1,77 Gramm wiegt. Die Dichte eines Stoffes hängt von seiner Temperatur und seinem Druck ab und kann daher unter verschiedenen Bedingungen leicht variieren.
Molekulargewicht von Ammoniumsulfat
Das Molekulargewicht von (NH4)2SO4 entspricht seiner Molmasse, die 132,14 g/mol beträgt. Das Molekulargewicht ist die Masse eines Mols einer Substanz, was 6,022 x 10^23 Molekülen entspricht. Das Molekulargewicht kann auch in Atommasseneinheiten (amu) ausgedrückt werden, die 1/12 der Masse eines Kohlenstoff-12-Atoms entsprechen. In amu beträgt das Molekulargewicht von (NH4)2SO4 132,14 amu.
Struktur von Ammoniumsulfat
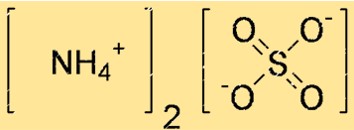
Die Struktur von (NH4)2SO4 kann durch eine Lewis-Punktstruktur oder ein Kugel-Stab-Modell dargestellt werden. Eine Lewis-Punktstruktur zeigt die Valenzelektronen jedes Atoms und die Bindungen zwischen ihnen. Ein Kugel-Stab-Modell zeigt die Form und Größe jedes Atoms und die Bindungen zwischen ihnen.
In der obigen Struktur stellen Doppellinien (=) Doppelbindungen dar, einzelne Linien (-) stellen Einfachbindungen dar und Punkte (.) stellen freie Elektronenpaare dar.
Löslichkeit von Ammoniumsulfat
Die Löslichkeit von (NH4)2SO4 ist die Menge an (NH4)2SO4, die sich in einer bestimmten Menge Wasser bei einer bestimmten Temperatur lösen kann. Die Löslichkeit von (NH4)2SO4 nimmt mit steigender Temperatur zu, wie die folgenden Daten zeigen:
| Temperatur (°C) | Löslichkeit (g/100 ml Wasser) |
| 0 | 70.6 |
| Aussehen | Feine weiße hygroskopische Körnchen oder Kristalle |
| Spezifische Dichte | 1,77 |
| Farbe | Weiß |
| Geruch | Geruchlos |
| Molmasse | 132,14 g/Mol |
| Dichte | 1,77 g/cm3 |
| Fusionspunkt | 235 bis 280°C (zersetzt sich) |
| Siedepunkt | Nicht anwendbar (zerlegt) |
| Blitzpunkt | Nicht brennbar |
| Löslichkeit in Wasser | 70,6 g pro 100 g Wasser (0°C), 74,4 g pro 100 g Wasser (20°C), 103,8 g pro 100 g Wasser (100°C) |
| Löslichkeit | Unlöslich in Aceton, Alkohol und Ether |
| Dampfdruck | Unerheblich |
| Wasserdampfdichte | Unzutreffend |
| pKa | 5,5 (für Ammoniumion) |
| pH-Wert | 5 bis 6 (für eine 5 %ige Lösung) |
Sicherheit und Gefahren von Ammoniumsulfat
(NH4)2SO4 ist für die menschliche Gesundheit nicht sehr gefährlich, kann jedoch bei Kontakt oder Einatmen Reizungen der Haut, Augen, Nase und Rachen verursachen. Bei Einnahme kann es außerdem zu Übelkeit, Magenschmerzen, Durchfall, Erbrechen und Schläfrigkeit kommen. Es ist schädlich für Wasserlebewesen und seine Freisetzung in die Umwelt sollte vermieden werden. Beim Erhitzen über 235 °C zersetzt es sich und bildet giftige Gase wie Ammoniak und Schwefelsäure. Es gilt als Lebensmittelzusatzstoff allgemein als sicher, kann jedoch bei manchen Menschen allergische Reaktionen oder Asthmasymptome hervorrufen.
| Gefahrensymbole | Nicht nötig |
| Sicherheitsbeschreibung | Freisetzung in die Umwelt vermeiden. Inhalt/Behälter einer zugelassenen Abfallentsorgungsanlage zuführen. |
| UN-Identifikationsnummern | Unzutreffend |
| HS-Code | 31022100 |
| Gefahrenklasse | Unzutreffend |
| Verpackungsgruppe | Unzutreffend |
| Toxizität | LD50 (oral, Ratte) = 2,840 mg/kg |
Methoden zur Synthese von Ammoniumsulfat
(NH4)2SO4 kann auf verschiedene Weise synthetisiert werden, da es ein anorganisches Salz ist. Einige der gängigen Methoden sind:
- Neutralisation von Ammoniak und Schwefelsäure: Bei dieser Methode wird Ammoniakgas oder eine wässrige Lösung mit Schwefelsäure gemischt und das Wasser verdampft, um (NH4)2SO4-Kristalle zu erhalten.
2NH3 + H2SO4 -> (NH4)2SO4
- Ammoniumcarbonat- und Gipsreaktion: Bei dieser Methode wird fein verteilter Gips ( Calciumsulfat ) zu einer Ammoniumcarbonatlösung gegeben und der Calciumcarbonat-Niederschlag filtriert.
(NH4)2CO3 + CaSO4 -> (NH4)2SO4 + CaCO3
- Nebenprodukt anderer Prozesse: Bei verschiedenen industriellen Prozessen wie der Kokereigasreinigung, der Caprolactam-Herstellung, der Nickelraffinierung und der Rauchgasentschwefelung kann (NH4)2SO4 als Nebenprodukt entstehen. Bei diesen Verfahren werden Ammoniak oder Ammoniumverbindungen verwendet, um Schwefel oder andere Verunreinigungen aus Gasströmen zu entfernen, was zu (NH4)2SO4 als Abfall oder Wertprodukt führt.
Verwendung von Ammoniumsulfat
(NH4)2SO4 ist ein anorganisches Salz, das verschiedene Verwendungsmöglichkeiten hat, wie zum Beispiel:
- Alkalischer Bodendünger: (NH4)2SO4 senkt den pH-Wert des Bodens und liefert Stickstoff und Schwefel für das Pflanzenwachstum. Es eignet sich für Kulturen, die saure Böden benötigen, wie Blaubeeren, Kartoffeln und Tomaten.
- Landwirtschaftlicher Spritzhilfsstoff: (NH4)2SO4 verbessert die Wirksamkeit wasserlöslicher Insektizide, Herbizide und Fungizide, indem es Eisen- und Kalziumionen bindet, die deren Wirkung beeinträchtigen können. Es verbessert auch die Aufnahme von Glyphosat und anderen systemischen Herbiziden durch Pflanzen.
- Proteinreinigung: (NH4)2SO4 kann Proteine aus wässrigen Lösungen ausfällen, indem es die Ionenstärke erhöht und die Proteinlöslichkeit verringert. Mit der Aussalzmethode können Proteine nach ihrer Größe, Ladung und Hydrophobie getrennt werden.
- Lebensmittelzusatzstoff: Verschiedene Lebensmittel wie Brot, Käse, Wein und Gemüsekonserven verwenden (NH4)2SO4 als Säureregulator, Teigkonditionierer, Hefenährstoff und Festigungsmittel. Die FDA erkennt es als allgemein sicher an.
- Andere Verwendungen: (NH4)2SO4 kann zur Herstellung anderer Ammoniumsalze, Feuerlöscher, Flammschutzmittel, Ledergerben, Textilfärben, Metallgalvanisierung und analytische Chemie verwendet werden.
Fragen:
F: Wie lautet die chemische Formel von Ammoniumsulfat?
A: Die chemische Formel für Ammoniumsulfat lautet (NH4)2SO4. Das bedeutet, dass ein Molekül Ammoniumsulfat zwei Ammoniumionen (NH4)+ und ein Sulfation (SO4)2- enthält.
F: Ist Ammoniumsulfat löslich?
A: (NH4)2SO4 ist in Wasser löslich, aber unlöslich in Aceton, Alkohol und Ether. Es kann 70,6 Gramm pro 100 Gramm Wasser bei 0 °C, 74,4 Gramm pro 100 Gramm Wasser bei 20 °C und 103,8 Gramm pro 100 Gramm Wasser bei 100 °C lösen.
F: Wie viel Ammoniumsulfat pro Gallone Wasser?
A: Die Menge an (NH4)2SO4 pro Gallone Wasser hängt von der gewünschten Konzentration und der Wassertemperatur ab. Wenn die gewünschte Konzentration beispielsweise 10 % (Gew./Vol.) beträgt und die Wassertemperatur 20 °C beträgt, beträgt die Menge an (NH4)2SO4 pro Gallone Wasser:
10 % (w/v) = 10 Gramm pro 100 ml Wasser 1 Gallone = 3785,41 ml 10 Gramm x 3785,41 ml / 100 ml = 378,54 Gramm Daher beträgt die Menge an (NH4)2SO4 pro Gallone Wasser 378,54 Gramm.
F: Kommt es zu einer Reaktion, wenn wässrige Lösungen von Ammoniumsulfat und Calciumchlorid kombiniert werden?
A: Nein, es findet keine Reaktion statt, wenn wässrige Lösungen von (NH4)2SO4 und Calciumchlorid kombiniert werden. Tatsächlich sind die beiden Salze wasserlöslich und bilden keinen unlöslichen Niederschlag. Die resultierende Lösung enthält vier Ionen: Ammonium (NH4)+, Sulfat (SO4)2-, Calcium (Ca2+) und Chlorid (Cl)-.
F: Wie kann man Proteine mit Ammoniumsulfat ausfällen?
A: Um Proteine mit (NH4)2SO4 auszufällen, können die folgenden Schritte befolgt werden:
- Bereiten Sie eine wässrige Lösung von (NH4)2SO4 mit bekannter Konzentration und bekanntem Volumen vor.
- Geben Sie die Proteinlösung langsam und unter Rühren zur (NH4)2SO4-Lösung.
- Überwachen Sie die Trübung oder optische Dichte der Mischung, um die Menge der Proteinausfällung zu bestimmen.
- Zentrifugieren Sie die Mischung, um das Proteinpellet vom Überstand zu trennen.
- Den Überstand verwerfen und das Proteinpellet mit Puffer oder Wasser waschen, um überschüssiges Salz zu entfernen.
- Resuspendieren oder lösen Sie das Proteinpellet in einem geeigneten Puffer zur weiteren Analyse oder Verwendung.
F: Wie viele Gramm sind in 6,90 Molekülen Ammoniumsulfat enthalten?
A: Um herauszufinden, wie viele Gramm in 6,90 Molekülen (NH4)2SO4 enthalten sind, müssen wir die Avogadro-Zahl und die Molmasse von (NH4)2SO4 verwenden. Die Avogadro-Zahl ist 6,022 x 10^23, was bedeutet, dass ein Mol einer Substanz so viele Moleküle enthält. Die Molmasse von (NH4)2SO4 beträgt 132,14 g/mol, was bedeutet, dass ein Mol (NH4)2SO4 so viele Gramm wiegt. Daher können wir diese Formel verwenden, um zu berechnen, wie viel Gramm in 6,90 Molekülen (NH4)2SO4 enthalten sind:
Gramm = Moleküle x Molmasse / Avogadro-Zahl Gramm = 6,90 x 132,14 / 6,022 x 10^23 Gramm = 1,52 x 10^-21 Daher sind in 6,90 Molekülen (NH4)2SO4 1,52 x 10^-21 Gramm enthalten.
F: Wie viel Schwefel ist in Ammoniumsulfat enthalten?
A: (NH4)2SO4 enthält 24 Masse-% Schwefel. Dies kann mithilfe der Formel für die prozentuale Zusammensetzung und der Molmassen von Schwefel und (NH4)2SO4 berechnet werden. Die Molmasse von Schwefel beträgt 32,06 g/mol und die Molmasse von (NH4)2SO4 beträgt 132,14 g/mol. Daher beträgt der Schwefelanteil in (NH4)2SO4:
Prozentsatz = Molmasse von Schwefel x 100 / Molmasse von Ammoniumsulfat Prozentsatz = 32,06 x 100 / 132,14 Prozentsatz = 24,26 %
F: Welches dieser Salze ist ein Neutralsalz? na2so4 nacn kf (nh4)2so4
A: Ein neutrales Salz ist ein Salz, das den pH-Wert der Lösung nicht beeinflusst, wenn es in Wasser gelöst wird. Es entsteht durch die Reaktion einer starken Säure und einer starken Base. Von den vier angegebenen Salzen ist nur na2so4 ein Neutralsalz. Es entsteht durch die Reaktion von Natriumhydroxid (einer starken Base) und Schwefelsäure (einer starken Säure). Andere Salze sind entweder sauer oder basisch. Nacn ist ein basisches Salz, das durch die Reaktion von Natriumhydroxid (einer starken Base) und Blausäure (einer schwachen Säure) entsteht. Kf ist ein basisches Salz, das durch die Reaktion von Kaliumhydroxid (einer starken Base) und Flusssäure (einer schwachen Säure) entsteht. (Nh4)2so4 ist ein Säuresalz, das durch die Reaktion von Ammoniumhydroxid (einer schwachen Base) und Schwefelsäure (einer starken Säure) entsteht.
F: Wie groß ist die Molmasse von (nh4)2so4?
A: Die Molmasse von (nh4)2so4 beträgt 132,14 g/mol. Um die Molmasse zu ermitteln, müssen wir die Atommassen aller Atome in der Formel addieren. Die Atommassen sind:
- Stickstoff: 14,01 g/mol
- Wasserstoff: 1,01 g/mol
- Schwefel: 32,06 g/mol
- Sauerstoff: 16,00 g/mol
Somit beträgt die Molmasse von (nh4)2so4:
(2 x 14,01) + (8 x 1,01) + 32,06 + (4 x 16,00) = 132,14 g/mol
F: Ist (nh4)2so4 wasserlöslich?
A: Ja, (nh4)2so4 ist wasserlöslich. Es kann bis zu 70,6 Gramm pro 100 Gramm Wasser bei 0 °C, 74,4 Gramm pro 100 Gramm Wasser bei 20 °C und 103,8 Gramm pro 100 Gramm Wasser bei 100 °C lösen.
