Ammoniumpersulfat ((NH4)2S2O8) ist ein weißes Pulver. Es löst sich in Wasser und setzt Sauerstoff frei. Es kann bleichen, ätzen oder die Polymerisation initiieren.
| Name der IUPAC | Ammoniumperoxidisulfat |
| Molekularformel | (NH4)2S2O8 |
| CAS-Nummer | 7727-54-0 |
| Synonyme | Ammoniumpersulfat, Ammoniumperoxodisulfat, Diammoniumpersulfat, Diammoniumperoxidisulfat |
| InChI | InChI=1S/2H3N.H2O8S2/c;;1-9(2,3)7-8-10(4,5)6/h2*1H3;(H,1,2,3)(H,4,5 ,6) |
Eigenschaften von Ammoniumpersulfat
Ammoniumpersulfat-Formel
Die Formel für Ammoniumpersulfat lautet (NH4)2S2O8. Es besteht aus zwei Ammoniumkationen (NH4+) und einem Persulfatanion (S2O82-). Das Persulfatanion verfügt über zwei Sulfatgruppen (SO42-), die durch eine Peroxidbindung (OO) verbunden sind.
Molmasse von Ammoniumpersulfat
Die Molmasse von (NH4)2S2O8 beträgt 228,18 g/mol. Dies wird berechnet, indem die Atommassen aller Atome in der Formel addiert werden: 2 x 14,01 (N) + 8 x 1,01 (H) + 2 x 32,06 (S) + 8 x 16,00 (O).
Siedepunkt von Ammoniumpersulfat
(NH4)2S2O8 hat keinen Siedepunkt, da es sich vor Erreichen dieser Temperatur zersetzt. Es zerfällt bei etwa 120 °C (248 °F) in Ammoniak, Stickstoff, Sauerstoff und Wasser. Die Zersetzungsreaktion ist:
(NH4)2S2O8 -> 2NH3 + N2 + O2 + 2H2O
Schmelzpunkt von Ammoniumpersulfat
(NH4)2S2O8 hat keinen Schmelzpunkt, da es sich vor Erreichen dieser Temperatur zersetzt. Es zerfällt bei etwa 120 °C (248 °F) in Ammoniak, Stickstoff, Sauerstoff und Wasser. Die Zersetzungsreaktion ist:
(NH4)2S2O8 -> 2NH3 + N2 + O2 + 2H2O
Dichte von Ammoniumpersulfat g/ml
Die Dichte von (NH4)2S2O8 beträgt 1,98 g/ml bei 25 °C. Das bedeutet, dass ein Milliliter (NH4)2S2O8 1,98 Gramm wiegt.
Molekulargewicht von Ammoniumpersulfat
Das Molekulargewicht von (NH4)2S2O8 entspricht seiner Molmasse, die 228,18 g/mol beträgt. Das bedeutet, dass ein Mol (NH4)2S2O8 228,18 Gramm wiegt.
Struktur von Ammoniumpersulfat
Die Struktur von (NH4)2S2O8 kann durch die folgende Lewis-Struktur dargestellt werden:
OO
|| ||
O=S||-OOS||=O
|| ||
OO
/\
NH NH
\/
H
/\
NH NH
\/
H
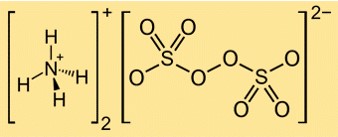
In dieser Struktur ist jedes Schwefelatom in einer tetraedrischen Geometrie an vier Sauerstoffatome gebunden und jedes Sauerstoffatom verfügt über zwei Paare freier Elektronen. Die Peroxidbindung zwischen den beiden Sulfatgruppen ist eine Einfachbindung mit einem Elektronenpaar. Ammoniumkationen werden aus Stickstoffatomen gebildet, die sich drei Elektronen mit jeweils drei Wasserstoffatomen teilen und eine positive Ladung haben.
Löslichkeit von Ammoniumpersulfat
(NH4)2S2O8 ist in Wasser sehr gut löslich, viel besser als das zugehörige Kaliumsalz 1 . Es löst sich in Wasser auf und bildet Ammoniumionen und Persulfationen, die weiter in Sulfatradikale zerfallen können:
(NH4)2S2O8 -> 2NH4+ + S2O82-
S2O82- -> 2 SO4•-
Die Löslichkeit von (NH4)2S2O8 in Wasser nimmt mit steigender Temperatur zu. Bei 25°C kann es bis zu 80g/100ml Wasser auflösen. Es ist auch in Methanol mäßig löslich.
| Aussehen | Weiße bis gelbliche Kristalle |
| Spezifische Dichte | 1,98 |
| Farbe | Weiß bis gelblich |
| Geruch | Süß und unangenehm |
| Molmasse | 228,18 g/Mol |
| Dichte | 1,98 g/ml bei 25 °C |
| Fusionspunkt | 120°C (zersetzt sich) |
| Siedepunkt | N/A (zerlegt) |
| Blitzpunkt | N / A |
| Löslichkeit in Wasser | 80 g/100 ml bei 25 °C |
| Löslichkeit | Mäßig löslich in MeOH |
| Dampfdruck | N / A |
| Wasserdampfdichte | N / A |
| pKa | N / A |
| pH-Wert | N / A |
Sicherheit und Gefahren von Ammoniumpersulfat
(NH4)2S2O8 ist ein starkes Oxidationsmittel, das Feuer verstärken und mit brennbaren Materialien explosionsartig reagieren kann. Es kann auch verschiedene gesundheitliche Auswirkungen haben, wenn es eingenommen, eingeatmet oder mit der Haut oder den Augen in Berührung kommt. Es kann Haut, Augen, Nase, Rachen und Lunge reizen. Es kann auch allergische Reaktionen wie Hautausschlag, Asthma oder Atembeschwerden hervorrufen. Es ist schädlich für Wasserlebewesen. Es muss daher vorsichtig und mit entsprechender Schutzausrüstung gehandhabt werden. Es muss fern von Hitze, Funken, Flammen und anderen unverträglichen Substanzen gelagert werden.
| Gefahrensymbole | O (Oxidationsmittel), Xn (gesundheitsschädlich), Xi (reizend) |
| Sicherheitsbeschreibung | S17 (Von brennbaren Materialien fernhalten), S26 (Bei Augenkontakt sofort mit viel Wasser ausspülen und einen Arzt konsultieren), S36/37/39 (Geeignete Schutzkleidung, Handschuhe und Augen-/Gesichtsschutz tragen), S45 (Im Falle eines Unfalls oder wenn Sie sich unwohl fühlen, suchen Sie sofort einen Arzt auf) |
| UN-Identifikationsnummern | UN 1444 |
| HS-Code | 28334000 |
| Gefahrenklasse | 5.1 (Oxidierende Materialien) |
| Verpackungsgruppe | III |
| Toxizität | Oral LD50 Ratte: 689 mg/kg, LC50 Inhalation Ratte: 2,95 mg/L/4h, dermal LD50 Ratte: 2000 mg/kg |
Methoden zur Synthese von Ammoniumpersulfat
Zur Herstellung von (NH4)2S2O8, einem anorganischen Salz, können verschiedene Methoden angewendet werden.
Eine der gebräuchlichsten Methoden ist die Elektrolyse einer kalten, konzentrierten Lösung aus Ammoniumsulfat ((NH4)2SO4) und Schwefelsäure (H2SO4) .
Diese Methode wurde erstmals von Hugh Marshall beschrieben. Bei der Elektrolyse wird mithilfe einer Platinanode und einer porösen Silberkathode ein elektrischer Strom durch die Lösung geleitet.
An der Anode entstehen durch Elektrolyse von Schwefelsäure Hydrogensulfat-Ionen HSO4-, die sich mit Wasser zu Persulfat-Ionen S2O82- und Wasserstoffgas H2 verbinden. An der Kathode wird Sauerstoffgas O2 reduziert, um Wasserstoffperoxid H2O2 zu erzeugen, das mit Ammoniumionen NH4+ zu (NH4)2S2O8 (NH4)2S2O8 und Wasser H2O reagiert.
Die Gesamtreaktion ist wie folgt:
(NH4)2SO4 + 2 H2SO4 -> (NH4)2S2O8 + 2 H2O + H2 + O2
Durch Abkühlen und Filtern kann (NH4)2S2O8 aus der Elektrolytlösung kristallisiert werden.
Eine weitere Methode zur Herstellung von (NH4)2S2O8 ist die Oxidation von Ammoniumbisulfat NH4HSO4 mit Ozon O3 oder Wasserstoffperoxid H2O2 . Diese Methode erzeugt eine höhere Ausbeute und Reinheit von (NH4)2S2O8 als die Elektrolysemethode. Die Reaktion ist:
NH4HSO4 + O3 -> (NH4)2S2O8 + H2O
Gold
NH4HSO4 + H2O2 -> (NH4)2S2O8 + 2H2O
Verwendung von Ammoniumpersulfat
(NH4)2S2O8 ist eine vielseitige Chemikalie, die in verschiedenen Branchen und Anwendungen vielfältig eingesetzt werden kann. Einige der häufigsten Anwendungen sind:
- Es dient als Bleichmittel und chemischer Vorläufer bei der Synthese anderer industriell wichtiger Verbindungen.
- Es leitet den Polymerisationsprozess ein und wird von den Herstellern vor allem bei der Herstellung von Polystyrol eingesetzt.
- Leiterplattenhersteller verwenden es als Ätzmittel, um Kupfer und andere Metalle von der Oberfläche zu entfernen.
- Die Halbleiterindustrie verwendet (NH4)2S2O8 auch als Ätzmittel zum Reinigen und Polieren von Siliziumwafern.
- Labore verwenden es als Reinigungs- und Desinfektionsmittel für Geräte, Glaswaren und Wassersysteme.
- Es verhindert die Bräunung von Obst und Gemüse und ist daher ein Zusatz zur Konservierung von Lebensmitteln.
- Verschiedene chemische Reaktionen nutzen es als Oxidationsmittel für die Synthese organischer Peroxide, Sulfone und Sulfonamide.
- Batterien nutzen es als Depolarisator, um ihre Leistung und Lebensdauer zu erhöhen.
- Haarbleichmittel verwenden es als häufigen Inhaltsstoff, um die Haarfarbe durch Oxidation des Melaninpigments aufzuhellen.
Fragen:
F: Wie lange ist Ammoniumpersulfat haltbar?
A: (NH4)2S2O8 ist eine stabile Verbindung, die im festen Zustand ohne Zersetzung unbegrenzt gelagert werden kann. Allerdings kann es mit der Zeit seine Wirksamkeit verlieren, wenn es in Wasser gelöst wird. Die Haltbarkeit einer 10 %igen Lösung von (NH4)2S2O8 beträgt etwa 2 bis 4 Wochen bei Raumtemperatur und 2 bis 3 Monate bei 4 °C 1 2 . Die Lösung sollte vor Licht und Hitze geschützt und regelmäßig auf das Vorhandensein von Blasen oder Niederschlägen überprüft werden, die auf eine Zersetzung hinweisen.
F: Was bewirkt Ammoniumpersulfat?
A: (NH4)2S2O8 ist ein starkes Oxidationsmittel, das in wässriger Lösung Sauerstoffradikale freisetzen kann. Diese Radikale können verschiedene chemische Reaktionen wie Polymerisation, Bleiche, Ätzung, Reinigung und Desinfektion auslösen oder beschleunigen. (NH4)2S2O8 kann auch als Sulfationenquelle für die Synthese anderer Verbindungen dienen.
F: Womit Ammoniumpersulfat mischen?
A: (NH4)2S2O8 ist gut wasserlöslich und kann mit Wasser gemischt werden, um Lösungen unterschiedlicher Konzentration herzustellen. Die Löslichkeit von (NH4)2S2O8 in Wasser nimmt mit steigender Temperatur zu. Bei 25°C kann es bis zu 80g/100ml Wasser auflösen. Es ist auch in Methanol mäßig löslich. (NH4)2S2O8 sollte nicht mit unverträglichen Stoffen wie brennbaren Stoffen, Reduktionsmitteln, Metallen, Säuren oder Basen gemischt werden, da es mit diesen heftig oder explosionsartig reagieren kann.
F: Ist Ammoniumperoxidisulfat dasselbe wie Ammoniumpersulfat?
A: Ja, Ammoniumperoxidisulfat ist ein anderer Name für (NH4)2S2O8. Sie sind beide Synonyme für dieselbe Verbindung mit der Formel (NH4)2S2O8.
F: Wofür wird Ammoniumpersulfat in der SDS-PAGE verwendet?
A: SDS-PAGE (Natriumdodecylsulfat-Polyacrylamid-Gelelektrophorese) ist eine Technik zur Trennung von Proteinen anhand ihrer Größe und Ladung. (NH4)2S2O8 wird als Katalysator für die Polymerisation von Acrylamid- und Bisacrylamid-Monomeren zur Bildung einer Polyacrylamid-Gelmatrix verwendet. (NH4)2S2O8 erzeugt freie Radikale, die die Vernetzungsreaktion zwischen den Monomeren initiieren.
F: Wie stellt man 10 % Ammoniumpersulfat her?
A: Um eine 10 %ige Lösung von (NH4)2S2O8 herzustellen, wiegen Sie 10 g festes (NH4)2S2O8 ab und lösen Sie es in 90 ml destilliertem Wasser auf. Bis zur vollständigen Auflösung rühren und in einen 100-ml-Messkolben umfüllen. Mit destilliertem Wasser bis zur Marke auffüllen und gut vermischen. Bewahren Sie die Lösung in einer dunklen Flasche bei 4 °C oder Raumtemperatur auf.
F: Wie repariere ich ein durch einen Lichtbogen ausgelöstes Ammoniumpersulfat?
A: Ein Lichtbogen ist ein Defekt, der durch einen Lichtbogen verursacht wird, der die Oberfläche eines Metalls beschädigt. Dies kann die Festigkeit und Korrosionsbeständigkeit des Metalls verringern und zu Rissen oder Ausfällen führen. Um einen Lichtbogen zu reparieren, besteht eine Methode darin, (NH4)2S2O8 als Ätzmittel zu verwenden, um den betroffenen Bereich zu entfernen. Das Verfahren ist wie folgt:
- Reinigen Sie die Metalloberfläche mit Aceton oder Alkohol, um Schmutz und Fett zu entfernen.
- Tragen Sie mit einem Pinsel oder einem Wattestäbchen eine dünne Schicht Ammoniumpersulfatlösung (10–20 %) auf die Zündstelle des Lichtbogens auf.
- Warten Sie 5 bis 10 Minuten, bis Blasen auf der Oberfläche erscheinen, was darauf hindeutet, dass eine Oxidationsreaktion stattfindet.
- Spülen Sie die Oberfläche mit Wasser ab und trocknen Sie sie mit einem sauberen Tuch.
- Wiederholen Sie den Vorgang, bis der Lichtbogen vollständig gelöscht ist.
- Untersuchen Sie die Oberfläche auf Risse oder Vertiefungen und füllen Sie diese gegebenenfalls mit geeignetem Spachtelmaterial auf.
- Tragen Sie eine Schutzschicht oder Farbe auf, um weitere Korrosion zu verhindern.
F: Ist Ammoniumpersulfat ein Tensid?
A: Nein, (NH4)2S2O8 ist kein Tensid. Ein Tensid ist eine Substanz, die die Oberflächenspannung einer Flüssigkeit oder zwischen zwei Flüssigkeiten verringert und Mizellen oder Emulsionen bilden kann. (NH4)2S2O8 hat diese Eigenschaften nicht. Es ist ein Oxidationsmittel, das in wässriger Lösung Sauerstoffradikale freisetzen kann.
F: Welche Aspekte Ihres Experiments werden durch TEMED und Ammoniumpersulfat gesteuert?
A: TEMED und (NH4)2S2O8 werden verwendet, um die Polymerisation von Acrylamid- und Bisacrylamid-Monomeren zu steuern, um eine Polyacrylamid-Gelmatrix für die Elektrophorese zu bilden. TEMED und (NH4)2S2O8 wirken als freie Radikale erzeugende Katalysatoren, die die Vernetzungsreaktion zwischen Monomeren initiieren und beschleunigen. Die Konzentration und das Verhältnis von TEMED und (NH4)2S2O8 beeinflussen die Geschwindigkeit und Vollständigkeit der Polymerisation sowie die Porengröße und mechanische Festigkeit des Gels.
F: Reagiert Ammoniumpersulfat mit Luft?
A: Ja, (NH4)2S2O8 kann mit Luft reagieren, insbesondere unter feuchten Bedingungen. (NH4)2S2O8 kann Feuchtigkeit aus der Luft aufnehmen und hydrolysieren, wobei Ammoniumsulfat und Wasserstoffperoxid entstehen. Wasserstoffperoxid kann weiter in Wasser und Sauerstoffgas zerfallen und dabei Hitze und Druck freisetzen. Dies kann dazu führen, dass der (NH4)2S2O8-Behälter platzt oder explodiert, wenn er nicht ordnungsgemäß entlüftet wird. (NH4)2S2O8 kann auch mit Luftsauerstoff reagieren und Ozon bilden, ein giftiges Gas. Daher sollte (NH4)2S2O8 an einem kühlen, trockenen und gut belüfteten Ort gelagert werden, fern von Hitze, Funken, Flammen und anderen unverträglichen Substanzen.
