Was ist Ammonium NH4+?
Das Ammoniumion (NH4+) ist ein positiv geladenes mehratomiges Ion, das aus einem Stickstoffatom und vier Wasserstoffatomen besteht. Es kommt häufig in Düngemitteln und organischen Verbindungen vor.
| IUPAC-Name | Azanium |
| Molekularformel | NH4+ |
| CAS-Nummer | 14798-03-9 |
| Synonyme | Ammoniumkation, Tetrahydridostickstoff (1+), Aminonium, Azanium, Stickstoffhydridkation, Wasserstoffstickstoff, Stickstoffion |
| InChI | InChI=1S/H3N/h1H3/p+1 |
Hinweis: Bei InChI handelt es sich um das Ammoniumion in seiner einfachsten Form, mit einem einzelnen ionisierten Wasserstoff. Der tatsächliche InChI kann je nach chemischer Umgebung des Ammoniumions variieren.
Ammoniumformel
Die Formel für das Ammoniumion lautet NH4+. Es ist ein mehratomiges Kation, das aus einem Stickstoffatom und vier Wasserstoffatomen besteht. Das Ammoniumion entsteht durch Protonierung von Ammoniak (NH3) mit einem Wasserstoffion (H+). Das Ammoniumion ist ein häufiges Kation in anorganischen und organischen Verbindungen, einschließlich Düngemitteln, Pharmazeutika und Sprengstoffen.
Ammoniumkation
Das Ammoniumkation, auch NH4+ genannt, ist ein positiv geladenes mehratomiges Ion, das aus einem Stickstoffatom und vier Wasserstoffatomen besteht. Es entsteht, wenn Ammoniak (NH3) ein Proton (H+) von einer Säure aufnimmt, was zur Bildung eines Ammoniumsalzes führt.
Molmasse von Ammoniumionen
Die Molmasse des Ammoniumions (NH4+) beträgt 18,04 g/mol. Dieser Wert errechnet sich aus der Addition der Atommassen eines Stickstoffatoms (14,01 g/mol) und vier Wasserstoffatomen (jeweils 1,01 g/mol). Die Molmasse ist eine wichtige Eigenschaft des Ammoniumions, da sie die Umrechnung seiner Masse in Mol und umgekehrt ermöglicht. Dies ist bei vielen chemischen Berechnungen nützlich, beispielsweise bei der Bestimmung der Menge an Reaktanten, die für eine chemische Reaktion benötigt werden.
Siedepunkt von Ammoniumionen
Da das Ammoniumion normalerweise in einem Salz wie Ammoniumchlorid (NH4Cl) vorkommt, hat es keinen eigenen Siedepunkt. Stattdessen wird der Siedepunkt von Ammoniumchlorid, der bei 520 °C liegt, von verschiedenen Faktoren beeinflusst, wie etwa der Stärke der ionischen Bindung zwischen dem Ammoniumion und dem Chloridion sowie der Größe und Form des Ammoniumions.
Schmelzpunkt von Ammoniumionen
Ähnlich wie der Siedepunkt hat das Ammoniumion keinen Schmelzpunkt, da es kein Stoff ist, der in reiner Form vorliegt. Salze, die Ammoniumionen enthalten, wie z. B. Ammoniumnitrat (NH4NO3), haben jedoch einen Schmelzpunkt von 169,6 °C. Der Schmelzpunkt von Ammoniumnitrat wird durch die Stärke der Ionenbindung zwischen dem Ammoniumion und dem Nitration sowie durch die Kristallstruktur der Verbindung beeinflusst.
Dichte der Ammoniumionen g/ml
Die Dichte des Ammoniumions (NH4+) ist nicht anwendbar, da es ein mehratomiges Ion ist und nicht als separate Einheit existiert. Salze, die Ammoniumionen enthalten, wie z. B. Ammoniumsulfat (NH4)2SO4, haben jedoch bei Raumtemperatur eine Dichte von 1,77 g/cm³. Die Dichte von Salzen, die Ammoniumionen enthalten, wird von verschiedenen Faktoren beeinflusst, darunter der Größe und Form der Ionen, der Stärke der Ionenbindung und der Kristallstruktur der Verbindung.
Molekulargewicht von Ammoniumionen
Das Molekulargewicht des Ammoniumions (NH4+) beträgt 18,04 g/mol, berechnet durch Addition der Atommassen von einem Stickstoffatom und vier Wasserstoffatomen. Das Molekulargewicht ist eine wichtige Eigenschaft des Ammoniumions, da es die Umrechnung seiner Masse in Mol und umgekehrt ermöglicht. Dies ist bei vielen chemischen Berechnungen nützlich, beispielsweise bei der Bestimmung der Menge an Reaktanten, die für eine chemische Reaktion benötigt werden.
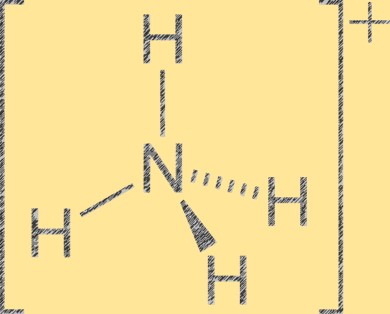
Struktur von Ammoniumionen
Das Ammoniumion (NH4+) hat eine tetraedrische Molekülgeometrie mit einem Stickstoffatom in der Mitte und vier Wasserstoffatomen an den Ecken des Tetraeders. Das Stickstoffatom hat eine positive Formalladung von +1, während jedes Wasserstoffatom eine Formalladung von -1 hat. Das Ammoniumion ist ein mehratomiges Kation, das durch Protonierung von Ammoniak (NH3) mit einem Wasserstoffion (H+) entsteht. Das Ammoniumion ist ein häufiges Kation in anorganischen und organischen Verbindungen, einschließlich Düngemitteln, Pharmazeutika und Sprengstoffen.
| Aussehen | Weißes oder farbloses kristallines festes Gas |
| Spezifisches Gewicht | Nicht anwendbar (mehratomiges Ion) |
| Farbe | Farblos |
| Geruch | Geruchlos |
| Molmasse | 18,04 g/Mol |
| Dichte | Nicht anwendbar (mehratomiges Ion), Salzdichte variiert (z. B. 1,77 g/cm³ für Ammoniumsulfat) |
| Fusionspunkt | Nicht anwendbar (mehratomiges Ion), Schmelzpunkt der Salze variiert (z. B. 169,6 °C für Ammoniumnitrat) |
| Siedepunkt | Nicht anwendbar (mehratomiges Ion), Siedepunkt von Salzen variiert (z. B. 520 °C für Ammoniumchlorid) |
| Blitzpunkt | Nicht anwendbar (mehratomiges Ion) |
| Löslichkeit in Wasser | Sehr gut löslich (vollständig mischbar) in Wasser |
| Löslichkeit | Löslich in Alkoholen und flüssigem Ammoniak |
| Dampfdruck | Nicht anwendbar (mehratomiges Ion) |
| Wasserdampfdichte | Nicht anwendbar (mehratomiges Ion) |
| pKa | 9,25 (konjugierte Säure, Ammoniumkation) |
| pH-Wert | 7 (neutral) in wässriger Lösung |
Hinweis: Die in der Tabelle angegebenen Werte können je nach chemischer Form und spezifischen Bedingungen des Ammoniumions variieren.
Sicherheit und Gefahren von Ammoniumionen
Das Ammoniumion in seiner reinen Form gilt allgemein als sicher und ungiftig. Wie viele chemische Verbindungen können Ammoniumionen jedoch bestimmte Gefahren und Risiken bergen, insbesondere bei unsachgemäßer Handhabung oder Verwendung. Das Ammoniumion kann giftiges Ammoniakgas freisetzen, wenn es mit starken Basen oder starken Säuren reagiert. Es kann außerdem eine Brand- und Explosionsgefahr darstellen, wenn es Hitze oder Flammen ausgesetzt wird. Darüber hinaus kann die Exposition gegenüber hohen Konzentrationen von Ammoniumionen oder seinen Derivaten zu Reizungen der Augen, der Haut und der Atemwege führen. Es ist wichtig, die richtigen Sicherheitsprotokolle zu befolgen und mit Ammoniumionen und ihren Derivaten vorsichtig umzugehen, um potenzielle Gefahren zu vermeiden.
| Gefahrensymbole | Keine Zuordnung für reines Ammoniumion |
| Sicherheitsbeschreibung | Gesundheitsschädlich bei Verschlucken, Einatmen oder Aufnahme durch die Haut. Verursacht Reizungen der Haut, Augen und Atemwege. Kann giftiges Ammoniakgas freisetzen. Kann eine Brand- und Explosionsgefahr darstellen. |
| EINE ID | 3077 (für Ammoniumverbindungen, einschließlich Ammoniumsalze) |
| HS-Code | 2827.10.00 (für Ammoniumchlorid, Ammoniumcarbonat und andere Ammoniumsalze) |
| Gefahrenklasse | 9 (Verschiedene gefährliche Stoffe und Gegenstände) für Ammoniumverbindungen, Klasse 8 (Ätzende Stoffe) für Ammoniumhydroxidlösung |
| Verpackungsgruppe | III (für Ammoniumverbindungen) |
| Toxizität | Gilt in reiner Form allgemein als ungiftig, kann jedoch giftiges Ammoniakgas freisetzen. Ammoniumverbindungen und -derivate können je nach ihren spezifischen Eigenschaften und ihrer Verwendung giftig oder schädlich für die menschliche Gesundheit und die Umwelt sein. |
Methoden zur Synthese von Ammoniumionen
Ammoniumionen können mithilfe verschiedener Methoden synthetisiert werden, darunter chemische Reaktionen und biologische Prozesse.
Eine übliche Methode zur Synthese des Ammoniumions besteht darin, Ammoniakgas mit einer Säure wie Salzsäure oder Schwefelsäure reagieren zu lassen, um Ammoniumsalz zu erzeugen. Bei der Reaktion werden Wasserstoffionen (H+) in der Säure durch Ammoniakmoleküle ersetzt, was zur Bildung eines Ammoniumkations (NH4+) und des entsprechenden Anions der Säure (z. B. Chlorid, Sulfat) führt. Das resultierende Ammoniumsalz kann gereinigt und kristallisiert werden, um ein Ammoniumion zu erhalten.
Auch biologische Prozesse wie der Abbau organischer Stoffe durch Mikroben können zur Bildung von Ammoniumionen führen. Bei diesem Prozess werden stickstoffhaltige Verbindungen von Bakterien und anderen Mikroorganismen abgebaut, wodurch Ammoniak und schließlich Ammoniumionen entstehen. Dieser Prozess wird als Ammonifikation bezeichnet und ist ein wichtiger Schritt im Stickstoffkreislauf.
Eine weitere Methode zur Synthese des Ammoniumions ist das Haber-Bosch-Verfahren, bei dem Stickstoffgas und Wasserstoffgas in Gegenwart eines Katalysators bei hohem Druck und hoher Temperatur reagieren. Das entstehende Ammoniakgas kann dann mit einer Säure reagieren, um ein Ammoniumion zu erzeugen.
Verwendung von Ammoniumionen
Das Ammoniumion wird in Industrie, Landwirtschaft und Labor auf vielfältige Weise eingesetzt.
Es eignet sich für ein breites Spektrum an Industrie-, Landwirtschafts- und Laborumgebungen, da es in der Landwirtschaft hauptsächlich als Dünger dient, Pflanzen mit leicht verfügbarem Stickstoff versorgt und gleichzeitig den pH-Wert des Bodens senkt.
Die chemische Industrie nutzt das Ammoniumion als Schlüsselbestandteil bei der Herstellung verschiedener Verbindungen wie Düngemitteln, Sprengstoffen und Pharmazeutika sowie bei der Synthese von Antibiotika und anderen Pharmazeutika. Das Ammoniumion fungiert in Form von Ammoniumnitrat auch als Sprengstoff.
In Laboratorien verwenden Forscher das Ammoniumion als Reaktant bei vielen chemischen Reaktionen, wie z. B. Fällungsreaktionen und organischen Synthesen, sowie als Puffermittel zur Stabilisierung des pH-Werts der Lösung.
Darüber hinaus werden Ammoniumionen aufgrund ihrer Fähigkeit, Bakterien und Pilze abzutöten, in Haushaltsreinigern als antimikrobielles Mittel verwendet.
Die vielfältigen Einsatzmöglichkeiten des Ammoniumions und seine Vielseitigkeit machen es zu einer unverzichtbaren Verbindung in verschiedenen Branchen und Anwendungen.
