NH4OH oder Ammoniumhydroxid ist eine klare, farblose Lösung, die allgemein als Haushaltsammoniak bekannt ist. Es handelt sich um eine stark alkalische Lösung mit einem pH-Wert von 11-12. Es wird als Reinigungsmittel, in der Düngemittelproduktion und in einigen Lebensmittelanwendungen als Trennmittel verwendet.
| IUPAC-Name | Ammoniumhydroxid |
| Molekularformel | NH4OH |
| CAS-Nummer | 1336-21-6 |
| Synonyme | Ammoniaklösung, wässriges Ammoniak, Haushaltsammoniak |
| InChI | InChI=1S/H5NO/c1-5(2,3)4/h(H,1,2,3,4)/p+1 |
Eigenschaften von Ammoniumhydroxid
Ammoniumhydroxid-Formel
Die chemische Formel für Ammoniumhydroxid lautet NH4OH. Die Formel gibt die relative Anzahl und Art der Atome in der Verbindung an. Das „N“ steht für Stickstoff, „H“ steht für Wasserstoff und „O“ steht für Sauerstoff. Die Indexzahlen in der Formel geben die Anzahl der Atome jedes Elements in der Verbindung an. Im Fall von Ammoniumhydroxid gibt es ein Stickstoffatom, vier Wasserstoffatome und ein Sauerstoffatom. Die Formel von Ammoniumhydroxid stellt die ionische Verbindung dar, die aus positiv geladenen Ammoniumionen (NH4+) und negativ geladenen Hydroxidionen (OH-) besteht.
Ammoniumhydroxid Ph
Der pH-Wert von Ammoniumhydroxid (NH4OH) ist basisch und liegt bei etwa 11. Das bedeutet, dass Ammoniumhydroxid eine hohe Konzentration an Hydroxidionen (OH-) aufweist und sehr alkalisch ist. Der pH-Wert von Ammoniumhydroxidlösungen kann je nach Konzentration, Temperatur und anderen Faktoren variieren, im Allgemeinen gilt es jedoch als starke Base mit einem pH-Wert über 7,0. Ammoniumhydroxid wird aufgrund seiner hohen Alkalität häufig in verschiedenen Industrie- und Haushaltsanwendungen wie Reinigung und pH-Wert-Einstellung verwendet. Es ist jedoch wichtig, mit Ammoniumhydroxid vorsichtig umzugehen, da es bei unsachgemäßer Handhabung ätzend und gefährlich sein kann.
Ammoniumhydroxid Sicherheitsdatenblatt
MSDS steht für Material Safety Data Sheet und ist ein Dokument, das Informationen über die Eigenschaften, Handhabung, Lagerung und Entsorgung einer chemischen Substanz liefert. Ein Sicherheitsdatenblatt für Ammoniumhydroxid (NH4OH) würde Informationen über seine physikalischen und chemischen Eigenschaften, mögliche gesundheitliche Auswirkungen, Brand- und Explosionsgefahren sowie alle Schutzmaßnahmen liefern, die bei der Handhabung oder Verwendung des Stoffes ergriffen werden sollten.
Das Sicherheitsdatenblatt für Ammoniumhydroxid würde auch Informationen zu seiner Toxizität, Reaktivität und Entflammbarkeit sowie alle geeigneten Erste-Hilfe-Maßnahmen im Falle einer Exposition enthalten. Darüber hinaus würde das Sicherheitsdatenblatt Informationen zur ordnungsgemäßen Lagerung und Entsorgung von Ammoniumhydroxid enthalten, einschließlich aller notwendigen Vorsichtsmaßnahmen zur Vermeidung von Verschüttungen oder Lecks.
Löslichkeit von Ammoniumhydroxid
Ammoniumhydroxid (NH4OH) ist in Wasser sehr gut löslich. Es bildet sich eine klare, farblose, stark alkalische Lösung mit charakteristischem Geruch. Die Löslichkeit von Ammoniumhydroxid in Wasser hängt von der Temperatur und der Konzentration ab, wobei höhere Temperaturen und Konzentrationen zu einer erhöhten Löslichkeit führen.
Im Allgemeinen löst sich Ammoniumhydroxid leicht in Wasser und erzeugt eine neutrale bis alkalische Lösung mit einem pH-Wert von etwa 9 bis 11. Die Löslichkeit von Ammoniumhydroxid in Wasser wird auch von anderen Faktoren wie Druck, Temperatur und dem Vorhandensein anderer Faktoren beeinflusst. gelöste Stoffe.
Ammoniumhydroxid Molmasse
Die Molmasse von Ammoniumhydroxid (NH4OH) beträgt 35,05 g/mol. Dieser Wert ist wichtig für die Bestimmung der Menge an Ammoniumhydroxid in einer Probe sowie für chemische Reaktionen, an denen die Verbindung beteiligt ist. Um die Molmasse eines Stoffes zu bestimmen, werden die Atomgewichte aller Elemente der Verbindung addiert. Im Fall von Ammoniumhydroxid wird die Molmasse durch Addition der Atomgewichte von Stickstoff (14,01 g/mol), Wasserstoff (1,01 g/mol) und Sauerstoff (16,00 g/mol) berechnet.
Siedepunkt von Ammoniumhydroxid
Der Siedepunkt von Ammoniumhydroxid liegt bei etwa 38 °C. Dieser Wert ist wichtig, um die Bedingungen zu bestimmen, unter denen die Verbindung von einer Flüssigkeit in einen Gaszustand übergeht. Ermitteln Sie den Siedepunkt von Ammoniumhydroxid, indem Sie den Dampfdruck der Substanz messen. Der Dampfdruck ist der Druck, den der Dampf über der Flüssigkeit in einem geschlossenen Behälter ausübt. Bedenken Sie, dass sich der Siedepunkt auch je nach Druck und Temperatur ändern kann.
Schmelzpunkt von Ammoniumhydroxid
Der Schmelzpunkt von Ammoniumhydroxid liegt bei -77°C. Dieser Wert ist wichtig, um die Bedingungen zu bestimmen, unter denen sich die Verbindung von einem Feststoff in eine Flüssigkeit umwandelt. Messen Sie den Schmelzpunkt von Ammoniumhydroxid, indem Sie die Stärke seiner intermolekularen Bindungen beurteilen. Bedenken Sie, dass der Schmelzpunkt je nach Druck und Temperatur der Umgebung variieren kann.
Dichte von Ammoniumhydroxid g/ml
Die Dichte von Ammoniumhydroxid beträgt etwa 0,91 g/ml. Dieser Wert ist wichtig für die Bestimmung der Menge an Ammoniumhydroxid in einem bestimmten Volumen sowie für die Berechnung der Masse der Substanz in einem bestimmten Volumen. Bestimmen Sie die Dichte von Ammoniumhydroxid, indem Sie seine Masse durch das Volumen dividieren, das es einnimmt. Bedenken Sie, dass sich die Dichte eines Stoffes je nach Temperatur und Druck ändern kann.
Molekulargewicht von Ammoniumhydroxid
Das Molekulargewicht von Ammoniumhydroxid beträgt 35,05 g/mol. Dieser Wert ist wichtig für die Bestimmung der Menge an Ammoniumhydroxid in einer Probe sowie für chemische Reaktionen, an denen die Verbindung beteiligt ist. Berechnen Sie das Molekulargewicht von Ammoniumhydroxid, indem Sie die Atomgewichte von Stickstoff (14,01 g/mol), Wasserstoff (1,01 g/mol) und Sauerstoff (16,00 g/mol) addieren.
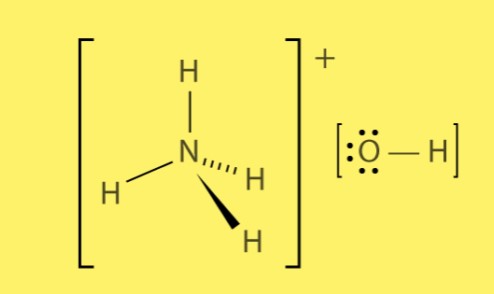
Struktur von Ammoniumhydroxid
Ammoniumhydroxid entsteht aus der Kombination positiv geladener Ammoniumionen (NH4+) und negativ geladener Hydroxidionen (OH-). Die ionischen Bindungen zwischen diesen Ionen erzeugen eine starke elektrostatische Anziehung, die zur Bildung der Verbindung führt.
| Aussehen | Klare, farblose Flüssigkeit |
| Spezifisches Gewicht | 0,91 g/ml |
| Farbe | Farblos |
| Geruch | Stechender Geruch, ähnlich wie Ammoniak |
| Molmasse | 35,05 g/Mol |
| Dichte | 0,91 g/ml |
| Fusionspunkt | -77°C |
| Siedepunkt | 38°C |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Vollständig löslich |
| Löslichkeit | Löslich in Ethanol und Methanol |
| Dampfdruck | 17,5 mmHg bei 20°C |
| Wasserdampfdichte | 0,6 (Luft = 1) |
| pKa | 10.64 |
| pH-Wert | 11.6 (1M-Lösung) |
Sicherheit und Gefahren von Ammoniumhydroxid
Ammoniumhydroxid ist eine stark alkalische Lösung und kann bei unsachgemäßer Handhabung gefährlich sein. Beim Einatmen kann es zu Haut- und Augenreizungen sowie Atemproblemen kommen. Bei Hautkontakt mit reichlich Wasser spülen und ggf. einen Arzt konsultieren. Bei Verschlucken kann es zu schweren Schäden oder zum Tod kommen. Daher ist es wichtig, es außerhalb der Reichweite von Kindern und Haustieren aufzubewahren. Es ist außerdem brennbar und sollte von Wärmequellen und Flammen ferngehalten werden. Bei der Verwendung von Ammoniumhydroxid ist es wichtig, Schutzausrüstung wie Handschuhe und Augenschutz zu tragen. Wenn etwas verschüttet wird, neutralisieren Sie es mit Säure und reinigen Sie es bei ausreichender Belüftung. Beim Umgang mit Ammoniumhydroxid sind die Einhaltung der Sicherheitsvorkehrungen und die ordnungsgemäße Lagerung unerlässlich.
| Gefahrensymbole | Ätzend |
| Sicherheitsbeschreibung | S26, S37/39 |
| UN-Identifikationsnummern | UN2672 |
| HS-Code | 2814.10.00 |
| Gefahrenklasse | 8 |
| Verpackungsgruppe | II |
| Toxizität | Gesundheitsschädlich bei Verschlucken, Einatmen oder Hautkontakt. Kann schwere Reizungen und Verbrennungen verursachen. |
Methoden zur Synthese von Ammoniumhydroxid
Ammoniumhydroxid kann nach zwei Hauptmethoden synthetisiert werden: dem Ammoniumchlorid-Verfahren und dem Ammoniak-Verfahren.
Beim Ammoniumchlorid-Verfahren handelt es sich um die Reaktion von Ammoniakgas und Salzsäure, wobei Ammoniumchlorid und Wasser entstehen:
NH3 + HCl → NH4Cl + H2O
Das Ammoniumchlorid wird dann in Wasser gelöst, um eine Ammoniumhydroxidlösung herzustellen. Diese Lösung kann durch Destillation weiter konzentriert werden, um eine konzentrierte Lösung von Ammoniumhydroxid herzustellen.
Der Ammoniakprozess beinhaltet die direkte Reaktion von Ammoniakgas und Wasser, wodurch Ammoniumhydroxid und Wasserstoffgas entstehen:
NH3 + H2O → NH4OH + H2
Die Produktion von Ammoniumhydroxid kann durch die Einstellung von Temperatur und Druck während der exothermen Reaktion gesteuert werden, wodurch eine Lösung entsteht, die durch Wasch- und Destillationstechniken gereinigt und konzentriert werden kann. Bei der industriellen Produktion von Ammoniumhydroxid wird aufgrund seiner Einfachheit und Effizienz üblicherweise das Ammoniakverfahren eingesetzt, das Ammoniumchloridverfahren dient jedoch als Ersatzoption bei Ammoniakengpässen.
Verwendung von Ammoniumhydroxid
Ammoniumhydroxid wird in verschiedenen Branchen vielfältig eingesetzt. Einige seiner häufigsten Anwendungen sind:
- In verschiedenen Haushalts- und Industrieanwendungen wird Ammoniumhydroxid als Reinigungsmittel verwendet, um Fette, Öle und Schmutz effektiv von Oberflächen zu entfernen.
- In der Lebensmittelindustrie wird es als Desinfektionsmittel eingesetzt, um Bakterien und Krankheitserreger auf Oberflächen mit Lebensmittelkontakt abzutöten. In der Landwirtschaft liefert Ammoniumhydroxid essentiellen Stickstoff als Dünger für das Pflanzenwachstum und ist ein wichtiger Bestandteil bei der Herstellung von Ammoniumnitratdünger.
- In der pharmazeutischen Industrie wird es bei der Herstellung bestimmter Medikamente und als pH-Regler bei der Herstellung bestimmter medizinischer Produkte verwendet.
- Die Backindustrie verwendet Ammoniumhydroxid als Backtriebmittel, um den Teig aufgehen zu lassen. Außerdem dient es als Aromastoff in einigen Lebensmitteln und als pH-Regler bei der Herstellung einiger Lebensmittel und Getränke.
- In der Textilindustrie neutralisiert Ammoniumhydroxid Säuren und reguliert den pH-Wert in der Textilproduktion. Bei der Wasseraufbereitung reguliert es den pH-Wert und entfernt Verunreinigungen.
Insgesamt ist Ammoniumhydroxid eine vielseitige und weit verbreitete Chemikalie mit Anwendungen in verschiedenen Branchen. Der sichere Umgang mit Ammoniumhydroxid ist jedoch wichtig, da es bei unsachgemäßer Handhabung gefährlich sein kann.
Fragen:
Ist Ammoniumhydroxid löslich?
Ja, Ammoniumhydroxid ist in Wasser sehr gut löslich. Es bildet sich eine klare, farblose, stark alkalische Lösung mit charakteristischem Geruch. Die Löslichkeit von Ammoniumhydroxid in Wasser hängt von der Temperatur und der Konzentration ab, wobei höhere Temperaturen und Konzentrationen zu einer erhöhten Löslichkeit führen.
Wie lautet die chemische Formel für Ammoniumhydroxid?
Die chemische Formel für Ammoniumhydroxid lautet NH4OH.
Wie lautet die Formel für Ammoniumhydroxid?
Die Formel für Ammoniumhydroxid lautet NH4OH.
Ist Ammoniumhydroxid eine starke Base?
Ja, Ammoniumhydroxid gilt als starke Base. Es dissoziiert vollständig in Wasser und bildet Hydroxidionen (OH-) und Ammoniumionen (NH4+), wodurch es mit einem pH-Wert von etwa 11 sehr alkalisch wird. Diese hohe Alkalität macht es zu einer nützlichen Chemikalie in verschiedenen industriellen und häuslichen Anwendungen, wie z. B. Reinigung und pH-Einstellung. Es ist jedoch wichtig, vorsichtig mit Ammoniumhydroxid umzugehen, da es bei unsachgemäßer Handhabung ätzend und gefährlich sein kann.
zusammengesetzter Name nh4oh
Der Name der chemischen Verbindung von NH4OH ist Ammoniumhydroxid.
Name nh4oh
Der Name NH4OH ist Ammoniumhydroxid.
