Ammoniumchlorid oder NH4Cl ist ein weißes kristallines Salz, das in verschiedenen Anwendungen, einschließlich Medizin und Düngemitteln, verwendet wird. Es entsteht durch die Reaktion von Ammoniak und Salzsäure und hat einen deutlich salzigen Geschmack.
| IUPAC-Name | Ammoniumchlorid |
| Molekularformel | NH4Cl |
| CAS-Nummer | 12125-02-9 |
| Synonyme | Sal-Ammoniak, Salmiac, Nushadir-Salz, Amchlor, Sal-Armagnac, Hydrochlorat, Ammoniummuriat, Sal-Armagnac |
| InChI | InChI=1S/ClH.H3N/h1H;1H3 |
Molmasse von NH4Cl
Ammoniumchlorid hat eine Molmasse von 53,49 g/mol. Die Molmasse bezieht sich auf die Masse eines Mols einer Substanz und wird in Gramm pro Mol (g/mol) ausgedrückt. Die Molmasse von Ammoniumchlorid wird durch Addition der Atommassen seiner Atombestandteile Stickstoff (N), Wasserstoff (H) und Chlor (Cl) bestimmt. Die Summenformel für Ammoniumchlorid lautet NH4Cl, was bedeutet, dass es ein Stickstoffatom, vier Wasserstoffatome und ein Chloratom enthält. Daher kann die Molmasse von Ammoniumchlorid wie folgt berechnet werden
Molmasse = (1 x Atommasse von N) + (4 x Atommasse von H) + (1 x Atommasse von Cl)
= (1 x 14,01 g/mol) + (4 x 1,01 g/mol) + (1 x 35,45 g/mol)
= 53,49 g/Mol
Siedepunkt von Ammoniumchlorid
Der Siedepunkt von Ammoniumchlorid liegt bei 520 °C (968 °F). Der Siedepunkt ist die Temperatur, bei der der Dampfdruck einer Flüssigkeit dem auf sie ausgeübten Außendruck entspricht. Bei dieser Temperatur verdampft Ammoniumchlorid und geht in einen gasförmigen Zustand über. Der hohe Siedepunkt von Ammoniumchlorid ist auf seine starken ionischen Bindungen zwischen Ammonium- (NH4+) und Chloridionen (Cl-) zurückzuführen.
Schmelzpunkt von Ammoniumchlorid
Der Schmelzpunkt von Ammoniumchlorid beträgt 338 °C (640 °F). Der Schmelzpunkt ist die Temperatur, bei der ein Feststoff flüssig wird. Bei dieser Temperatur werden die ionischen Bindungen zwischen den Ammonium- (NH4+) und Chlorid-Ionen (Cl-) aufgebrochen und das Ammoniumchlorid wandelt sich von einem Feststoff in eine Flüssigkeit um. Ammoniumchlorid hat im Vergleich zu anderen ionischen Verbindungen einen relativ niedrigen Schmelzpunkt, was es für bestimmte Anwendungen wie Schweißen und Metallurgie nützlich macht.
Dichte von Ammoniumchlorid g/ml
Die Dichte von Ammoniumchlorid beträgt 1,527 g/cm³. Die Dichte ist ein Maß für die Masse pro Volumeneinheit eines Stoffes. Die hohe Dichte von Ammoniumchlorid ist auf seine sehr kompakte Ionengitterstruktur zurückzuführen. Ammoniumchlorid hat eine höhere Dichte als Wasser, was bedeutet, dass es im Wasser sinkt.
Molekulargewicht von Ammoniumchlorid
Das Molekulargewicht von Ammoniumchlorid beträgt 53,49 g/mol. Das Molekulargewicht ist die Summe der Atomgewichte aller Atome in einem Molekül. Das Molekulargewicht von Ammoniumchlorid entspricht seiner Molmasse.
Struktur von Ammoniumchlorid
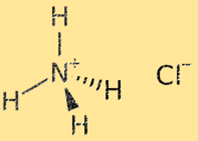
Die Struktur von Ammoniumchlorid ist ein Kristallgitter, das aus abwechselnden Ammonium- (NH4+) und Chloridionen (Cl-) besteht. Das Ammoniumion ist ein mehratomiges Ion mit positiver Ladung (+1), bestehend aus einem Stickstoffatom und vier Wasserstoffatomen. Das Chloridion ist ein einatomiges Ion mit negativer Ladung (-1), bestehend aus einem Chloratom. Die Kristallgitterstruktur von Ammoniumchlorid wird durch starke ionische Bindungen zwischen Ammonium- und Chloridionen stabilisiert, was zu einem sehr stabilen und spröden Feststoff führt.
Ammoniumchlorid-Formel
Die Formel für Ammoniumchlorid lautet NH4Cl. Es besteht aus einem Ammoniumion (NH4+) und einem Chloridion (Cl-). Die Formel stellt das Verhältnis der Atome in einem Molekül dar und zeigt, dass es für jedes Ammoniumion ein Chloridion gibt. Die Ammoniumchloridformel wird verwendet, um die Molmasse, Dichte und andere Eigenschaften der Verbindung zu bestimmen.
| Aussehen | Weißer kristalliner Feststoff |
| Spezifisches Gewicht | 1.527 g/cm³ |
| Farbe | Farblos bis weiß |
| Geruch | Geruchlos |
| Molmasse | 53,49 g/Mol |
| Dichte | 1.527 g/cm³ |
| Fusionspunkt | 338 °C (640 °F) |
| Siedepunkt | 520 °C (968 °F) |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | 29,7 g/100 ml (25 °C) |
| Löslichkeit | Löslich in Ethanol und Aceton |
| Dampfdruck | Unzutreffend |
| Wasserdampfdichte | Unzutreffend |
| PKa | 9:25 Uhr |
| pH-Wert | 4,6 (5%ige Lösung) |
Sicherheit und Gefahren von Ammoniumchlorid
Ammoniumchlorid (NH4Cl) gilt im Allgemeinen als sicher für den normalen Gebrauch. Allerdings kann es schädlich sein, wenn es in großen Mengen eingenommen oder eingeatmet wird. Das Verschlucken von NH4Cl kann zu Mund- und Rachenreizungen, Übelkeit, Erbrechen und Durchfall führen. Das Einatmen von NH4Cl kann zu Reizungen der Atemwege, Husten und Kurzatmigkeit führen. NH4Cl sollte mit Vorsicht gehandhabt werden, da es Haut- und Augenreizungen verursachen kann. Es ist auch wichtig, den Kontakt mit NH4Cl-Staub oder -Dampf zu vermeiden, da diese Reizungen für Augen, Nase und Rachen hervorrufen können. Beim Umgang mit NH4Cl sollte geeignete persönliche Schutzausrüstung wie Handschuhe und Schutzbrille getragen werden.
| Gefahrensymbole | XI |
| Sicherheitsbeschreibung | S22, S24/25, S36/37/39 |
| UN-Identifikationsnummern | UN 3077 |
| HS-Code | 2827.10.00 |
| Gefahrenklasse | 9 – Verschiedene gefährliche Güter |
| Verpackungsgruppe | III |
| Toxizität | Geringe Toxizität, kann jedoch bei Verschlucken oder Einatmen großer Mengen schädlich sein. |
Methoden zur Synthese von Ammoniumchlorid
Ammoniumchlorid (NH4Cl) kann auf verschiedene Weise synthetisiert werden.
- Eine übliche Methode ist die Reaktion von Ammoniakgas mit Salzsäure in Wasser. Bei dieser exothermen Reaktion entsteht NH4Cl in Form eines weißen kristallinen Feststoffs. Es ist wichtig, die Salzsäure langsam und unter Rühren in das Wasser zu geben, um Spritzer durch die entstehende Hitze zu vermeiden.
- Eine andere Methode zur Herstellung von NH4Cl ist ein Nebenprodukt verschiedener industrieller Prozesse wie der Herstellung von Natriumcarbonat oder dem Solvay-Verfahren.
- Eine andere Möglichkeit, NH4Cl zu synthetisieren, ist die Reaktion von Ammoniak mit Natriumchlorid. Bei dieser Reaktion entstehen sowohl NH4Cl als auch Natriumhydroxid. Diese Reaktion ist exotherm und erfordert eine sorgfältige Kontrolle, um die Bildung unerwünschter Nebenprodukte zu vermeiden.
Verwendung von Ammoniumchlorid
Ammoniumchlorid (NH4Cl) wird in verschiedenen Branchen vielfältig eingesetzt.
- NH4Cl dient als Dünger in der Landwirtschaft und versorgt Nutzpflanzen mit wichtigen Nährstoffen wie Stickstoff und Chlorid, wodurch Ertrag und Qualität verbessert werden.
- Ammoniumchlorid erleichtert die ordnungsgemäße Funktion von Trockenzellen, indem es als Elektrolyt Strom leitet.
- Die Textilindustrie verwendet NH4Cl als Färbe- und Druckmittel, das dabei hilft, Farbstoffe auf Stoffen zu fixieren und die Farbechtheit zu verbessern.
- Als Flussmittel bei der Metallbearbeitung und beim Löten entfernt NH4Cl Oxidschichten von Metallen und ermöglicht so ein einfacheres Schweißen.
- Die Chemikalie wird in Lebensmitteln, Pharmazeutika und Kosmetika als Aromastoff, schleimlösend in Hustenmitteln und als Inhaltsstoff in Körperpflegeprodukten eingesetzt.
Insgesamt machen die einzigartigen Eigenschaften von NH4Cl es zu einer vielseitigen Chemikalie mit vielen wichtigen Anwendungen in verschiedenen Branchen.
Fragen:
F: Ist Ammoniumchlorid erhaben?
A: Ja, Ammoniumchlorid sublimiert bekanntermaßen, was bedeutet, dass es direkt von der festen Phase in die Gasphase übergehen kann, ohne dazwischen zu schmelzen.
F: Ist NH4Cl sauer oder basisch?
A: Ammoniumchlorid ist ein saures Salz. Wenn es in Wasser gelöst wird, kann es einer Hydrolyse unterliegen, wodurch eine saure Lösung entsteht. Dies liegt daran, dass das Ammoniumion als schwache Säure wirkt und ein Proton (H+) an Wassermoleküle abgibt.
F: Wie lautet die Formel für Ammoniumchlorid?
A: Die Formel für Ammoniumchlorid lautet NH4Cl. Es besteht aus einem Ammoniumion (NH4+) und einem Chloridion (Cl-), die durch Ionenbindungen zusammengehalten werden.
F: Löst sich Ammoniumchlorid in Wasser?
A: Ja, Ammoniumchlorid ist in Wasser gut löslich. Bei Raumtemperatur können sich etwa 29,7 Gramm Ammoniumchlorid in 100 Milliliter Wasser lösen.
F: Wie trennt man Ammoniumchlorid und Natriumchlorid?
A: Eine Möglichkeit, Ammoniumchlorid und Natriumchlorid zu trennen, ist die Sublimation. Dies kann durch Erhitzen der Mischung erreicht werden, wodurch das Ammoniumchlorid sublimiert, während das Natriumchlorid in fester Form verbleibt. Das sublimierte Ammoniumchlorid kann dann gesammelt und wieder in eine feste Form kondensiert werden. Eine andere Methode besteht darin, die Mischung in Wasser aufzulösen und dann eines der Salze mithilfe eines bestimmten Reagenzes oder einer pH-Wert-Einstellung selektiv auszufällen.
