Ammoniumcarbonat ((NH4)2CO3) ist ein Salz. Es entsteht, wenn Ammoniak und Kohlendioxid reagieren. Es hat viele Verwendungsmöglichkeiten, beispielsweise als Back- und Riechsalz.
| Name der IUPAC | Ammoniumcarbonat |
| Molekularformel | (NH4)2CO3 |
| CAS-Nummer | 506-87-6 |
| Synonyme | Backammoniak, flüchtiges Salz, Hirschhornsalz, E503 |
| InChI | InChI=1S/CH2O3.2H3N/c2-1(3)4;;/h(H2,2,3,4);2*1H3 |
Eigenschaften von Ammoniumcarbonat
Ammoniumcarbonat-Formel
Die chemische Formel oder Summenformel von Ammoniumcarbonat lautet (NH4)2CO3 1 . Es ist ein Salz, das aus zwei Ammoniumionen und einem Carbonation besteht. Es kann als NH4+ + NH4+ + CO3 2- geschrieben werden, um die Ladungen der Ionen anzuzeigen.
Molmasse von Ammoniumcarbonat
Die Molmasse von (NH4)2CO3 beträgt 96,09 g/mol 2 . Um die Molmasse zu berechnen, müssen wir die Atommassen aller Atome in der Formel addieren. Die Atommassen sind:
- Stickstoff: 14,01 g/mol
- Wasserstoff: 1,01 g/mol
- Kohlenstoff: 12,01 g/mol
- Sauerstoff: 16,00 g/mol
Somit beträgt die Molmasse von Ammoniumcarbonat:
(2 x 14,01) + (8 x 1,01) + 12,01 + (3 x 16,00) = 96,09 g/mol
Siedepunkt von Ammoniumcarbonat
(NH4)2CO3 hat keinen Siedepunkt, da es sich vor Erreichen dieser Temperatur zersetzt. Beim Erhitzen zerfällt es in Ammoniak und Kohlendioxid, die aus dem Feststoff entweichen. Die Zersetzungsreaktion ist:
(NH4)2CO3 -> 2NH3 + CO2 + H2O
Die Zersetzungstemperatur hängt von der Luftfeuchtigkeit und dem Druck der Umgebung ab, liegt jedoch im Allgemeinen bei etwa 60 °C.
Ammoniumcarbonat Schmelzpunkt
(NH4)2CO3 hat einen Schmelzpunkt von 58 °C (136 °F; 331 K). Allerdings zersetzt es sich auch bei dieser Temperatur und bildet daher keine flüssige Phase. Stattdessen sublimiert es direkt vom Feststoff in den Gaszustand.
Dichte von Ammoniumcarbonat g/ml
Die Dichte von (NH4)2CO3 beträgt 1,50 g/ml. Die Dichte ist die Masse pro Volumeneinheit eines Stoffes. Um die Dichte zu berechnen, dividieren Sie die Masse durch das Volumen. Wenn wir beispielsweise 10 g (NH4)2CO3 haben und es 6,67 ml Raum einnimmt, dann ist die Dichte:
10 g / 6,67 ml = 1,50 g/ml
Molekulargewicht von Ammoniumcarbonat
Das Molekulargewicht von (NH4)2CO3 entspricht seiner Molmasse, die 96,09 g/mol beträgt. Molekulargewicht und Molmasse werden oft synonym verwendet, haben jedoch leicht unterschiedliche Bedeutungen. Das Molekulargewicht ist die Masse eines Moleküls einer Substanz, während die Molmasse die Masse eines Mols (6,022 x 10^23 Moleküle) einer Substanz ist.
Struktur von Ammoniumcarbonat
Die Struktur von (NH4)2CO3 kann durch eine Lewis-Punktstruktur oder ein Kugel-Stab-Modell dargestellt werden. Eine Lewis-Punktstruktur zeigt die Valenzelektronen jedes Atoms und wie sie geteilt oder übertragen werden, um Bindungen zu bilden. Ein Kugel-Stab-Modell zeigt die Form und Anordnung von Atomen und Bindungen in drei Dimensionen.
Hier ist eine mögliche Lewis-Punkt-Struktur für Ammoniumcarbonat:
OOOOO
|| || ||
HNH HNH HCH
| | |
HHH
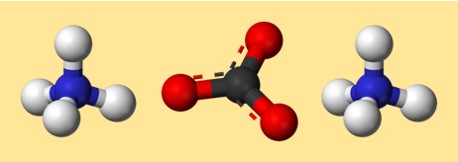
Hier ist ein mögliches Modell für Ammoniumcarbonat:
In diesem Modell stellt jede Farbe ein anderes Element dar:
- Grau: Carbon
- Rot: Sauerstoff
- Blau: Stickstoff
- Weiß: Wasserstoff
Löslichkeit von Ammoniumcarbonat
(NH4)2CO3 ist wasserlöslich. Löslichkeit ist die Fähigkeit eines Stoffes, sich in einem anderen Stoff aufzulösen. Wenn sich (NH4)2CO3 in Wasser löst, bildet es wässrige Ionen, die mit anderen Ionen oder Molekülen in Lösung interagieren können. Die Auflösungsreaktion ist:
(NH4)2CO3 + H2O -> 2 NH4+ + CO3 2- + H2O
Die Löslichkeit von (NH4)2CO3 hängt von der Temperatur und dem pH-Wert des Wassers ab. Bei höheren Temperaturen kann sich mehr (NH4)2CO3 in Wasser lösen.
| Aussehen | weißes Puder |
| Spezifische Dichte | 1,50 |
| Farbe | Farblos |
| Geruch | Stechender Geruch nach Ammoniak |
| Molmasse | 96,09 g/Mol |
| Dichte | 1,50 g/ml |
| Fusionspunkt | 58°C (136°F; 331K) |
| Siedepunkt | Zerfällt vor dem Kochen |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | 100g/100ml (15°C) |
| Löslichkeit | Löslich in Wasser, Alkohol und Aceton |
| Dampfdruck | Nicht verfügbar |
| Wasserdampfdichte | Nicht verfügbar |
| pKa | 9,25 (für NH4+) |
| pH-Wert | 7,8 (für eine 0,1-M-Lösung) |
Sicherheit und Gefahren von Ammoniumcarbonat
(NH4)2CO3 ist ein gefährlicher Stoff, der Reizungen und Schäden an Haut, Augen, Nase, Rachen und Lunge verursachen kann. Auch beim Verschlucken kann es gesundheitsschädlich sein. Es sollte mit Vorsicht und mit persönlicher Schutzausrüstung wie Handschuhen, Schutzbrillen und Masken gehandhabt werden. Es sollte an einem kühlen, trockenen und gut belüfteten Ort, fern von Hitze, Funken und Flammen, gelagert werden. Es sollte nicht mit starken Säuren, Basen oder Reduktionsmitteln gemischt werden, da es heftig reagieren oder giftige Gase freisetzen kann. Bei Exposition sofort einen Arzt aufsuchen.
| Gefahrensymbole | Xi (irritierend) |
| Sicherheitsbeschreibung | S22: Staub nicht einatmen. S24/25: Kontakt mit Haut und Augen vermeiden. |
| UN-Identifikationsnummern | UN3077 |
| HS-Code | 28369910 |
| Gefahrenklasse | 9 |
| Verpackungsgruppe | III |
| Toxizität | Orale LD50-Ratte: 2000 mg/kg |
Methoden zur Ammoniumcarbonat-Synthese
Abhängig von den Ausgangsmaterialien und der gewünschten Reinheit des Produkts können verschiedene Methoden zur Synthese von (NH4)2CO3 eingesetzt werden. Hier sind einige Beispiele für Methoden zur Synthese von (NH4)2CO3:
- Eine Methode besteht darin, Ammoniumsulfat mit Ammoniumchlorid und Calciumcarbonat in einem Ofen zur Reaktion zu bringen. Bei der Reaktion entstehen (NH4)2CO3 und Calciumchlorid als Nebenprodukte. Die Reaktion ist:
(NH4)2SO4 + 2 NH4Cl + CaCO3 -> 2 (NH4)2CO3 + CaCl2
- Eine andere Methode beinhaltet die Reaktion mit Kohlendioxid und Ammoniak in einer wässrigen Lösung. Bei der Reaktion entstehen (NH4)2CO3 und Wasser als Nebenprodukte. Die Reaktion ist:
CO2 + 2 NH3 + H2O -> (NH4)2CO3 + H2O
- Bei einer dritten Methode wird eine Ammoniumlösung kohlendioxidhaltiger Luft ausgesetzt. Ammoniumbicarbonat ist das Produkt der Reaktion und durch Erhitzen kann es weiter in (NH4)2CO3 zerlegt werden.
Die Reaktionen sind:
NH3 + CO2 + H2O -> NH4HCO3
NH4HCO3 -> NH3 + CO2 + H2O
(NH4)2CO3 -> (NH4)2CO3
- Wenn Ammoniumbicarbonat der Luft ausgesetzt wird, entsteht (NH4)2CO3 für die kommerzielle Nutzung. Ammoniumbicarbonat zerfällt in Ammoniak und Kohlendioxid, die wiederum zu (NH4)2CO3 reagieren. Der Prozess ist:
NH4HCO3 -> NH3 + CO2
NH3 + CO2 -> (NH4)2CO3
Verwendung von Ammoniumcarbonat
(NH4)2CO3 hat verschiedene Verwendungsmöglichkeiten in verschiedenen Bereichen, wie zum Beispiel:
- Bäcker verwenden es als Backmittel, insbesondere für flache oder knusprige Kekse und Cracker. Es entstehen Kohlendioxid- und Ammoniakgase, die dem Teig beim Aufgehen helfen und ihm eine leichte Konsistenz verleihen. Es verbessert auch den Geschmack und das Aroma von Backwaren.
- Menschen verwenden es als Riechsalz, um Menschen wiederzubeleben, die ohnmächtig geworden sind oder sich unglücklich fühlen. Es stimuliert die Atemwege und erhöht den Blutdruck, indem es Ammoniakdämpfe freisetzt, die Nase und Lunge reizen.
- Einige Hustensäfte und schleimlösende Mittel, wie z. B. Buckley’s Cough Syrup, verwenden es als Wirkstoff. Es hilft, Schleim aus Brust und Rachen zu lösen und auszutreiben, indem es die Schleimsekretion erhöht.
- Ärzte verwenden es als Brechmittel, um bei Vergiftungen oder Überdosierungen Erbrechen auszulösen. Es reizt die Magenschleimhaut und verursacht durch die Freisetzung von Kohlendioxid Übelkeit und Erbrechen.
- Chemiker verwenden es als Reagens bei einigen chemischen Reaktionen, beispielsweise bei der Synthese von Harnstoff, Ammoniumnitrat und Ammoniumsulfat. Es fungiert auch als Puffer, um den pH-Wert von Lösungen aufrechtzuerhalten.
Fragen:
F: Ist Ammoniumcarbonat sauer oder basisch?
A: (NH4)2CO3 ist ein Salz, das sowohl mit Säuren als auch mit Basen reagieren kann. Wenn es sich in Wasser auflöst, bildet es Ammoniumionen und Carbonationen. Ammoniumionen können als schwache Säuren wirken und Protonen an Wasser abgeben, während Carbonationen als schwache Basen wirken und Protonen aus Wasser aufnehmen können. Der pH-Wert der Lösung hängt von der relativen Stärke der Ammoniumionen und Carbonationen ab. Wenn Carbonationen stärkere Basen sind als Ammoniumionen Säuren, ist die Lösung basisch. Die Lösung ist sauer, wenn die Ammoniumionen stärkere Säuren sind als die Carbonationen Basen. Wenn die Ammoniumionen und Carbonationen ähnliche Stärken haben, ist die Lösung neutral.
F: Ist Ammoniumcarbonat ein Salz?
A: Ja, (NH4)2CO3 ist ein Salz. Ein Salz ist eine Verbindung, die entsteht, wenn eine Säure und eine Base einander neutralisieren. (NH4)2CO3 kann entstehen, wenn Ammoniak, eine schwache Base, mit Kohlensäure, einer schwachen Säure, reagiert. Die Reaktion ist:
2NH3 + H2CO3 -> (NH4)2CO3 + H2O
Ammoniak und Kohlensäure sind die Ausgangsbase und Säure von (NH4)2CO3.
F: Hat Ammoniumcarbonat (aq) in wässriger Form einen Geruch?
A: Ja, (NH4)2CO3 (aq) hat in wässriger Form einen Geruch. Der Geruch entsteht durch die Freisetzung von Ammoniakgas aus der Lösung. Ammoniakgas hat einen stechenden Geruch, der Nase und Lunge reizen kann. Ammoniakgas kann aus der Lösung entweichen, da es flüchtig ist und in Wasser nur schwer löslich ist. Die Menge des freigesetzten Ammoniakgases hängt von der Temperatur und Konzentration der Lösung ab.
F: Welche Art von Atom ist Ammoniumcarbonat?
A: (NH4)2CO3 ist kein Atom, sondern ein Molekül. Ein Molekül ist eine Gruppe von Atomen, die durch die gemeinsame Nutzung von Elektronen miteinander verbunden sind. Ein Atom ist die kleinste Materieeinheit mit einer definierten chemischen Identität. (NH4)2CO3 ist ein Molekül, das aus vier verschiedenen Atomarten besteht: Stickstoff, Wasserstoff, Kohlenstoff und Sauerstoff. Die Summenformel von (NH4)2CO3 lautet (NH4)2CO3.
F: Wie viele Mol enthält Ammoniumcarbonat?
A: Um diese Frage zu beantworten, müssen wir wissen, wie viel (NH4)2CO3 wir in Bezug auf Masse oder Volumen haben. Ein Mol ist eine Maßeinheit, die 6,022 x 10^23 Teilchen einer Substanz darstellt. Die Molzahl einer Substanz lässt sich berechnen, indem man ihre Masse durch ihre Molmasse dividiert oder ihr Volumen mit ihrer Molarität multipliziert. Die Molmasse von (NH4)2CO3 beträgt 96,09 g/mol. Die Molarität von (NH4)2CO3 hängt von seiner Auflösung in Wasser ab.
Wenn wir beispielsweise 10 g (NH4)2CO3 haben, können wir die Anzahl der Mol ermitteln, indem wir 10 g durch 96,09 g/mol dividieren:
10 g / 96,09 g/mol = 0,104 Mol
Wenn wir 100 ml einer 0,1 M (NH4)2CO3-Lösung haben, können wir die Anzahl der Mol ermitteln, indem wir 100 ml mit 0,1 mol/L multiplizieren:
100 ml x 0,1 Mol/L = 0,01 Mol
F: Wie lautet die chemische Formel von Ammoniumcarbonat?
A: Die chemische Formel für Ammoniumcarbonat lautet (NH4)2CO3. Diese Formel zeigt, dass ein Molekül (NH4)2CO3 zwei Ammoniumionen (NH4+) und ein Carbonation (CO3 2-) enthält. Die Ladungen der Ionen gleichen sich aus, sodass die Gesamtladung des Moleküls Null ist.
F: Wie viele Mol Ammoniumionen sind in 6,995 g Ammoniumcarbonat enthalten?
A: Um diese Frage zu beantworten, müssen wir zwei Schritte befolgen:
- Zuerst müssen wir bestimmen, wie viele Mol (NH4)2CO3 in 6,995 g enthalten sind, indem wir 6,995 g durch seine Molmasse (96,09 g/mol) dividieren:
6,995 g / 96,09 g/mol = 0,0728 Mol
- Zweitens müssen wir diese Zahl mit zwei multiplizieren, da jedes Mol (NH4)2CO3 zwei Mol Ammoniumionen enthält:
0,0728 Mol x 2 = 0,1456 Mol
In 6,995 g (NH4)2CO3 stecken also 0,1456 Mol Ammoniumionen.
F: Welches Gas entsteht, wenn Salzsäure mit Ammoniumcarbonat reagiert?
A: Wenn Salzsäure mit (NH4)2CO3 reagiert, kommt es zu einer doppelten Verdrängungsreaktion, bei der Ammoniumchlorid und Kohlensäure entstehen. Anschließend zerfällt die Kohlensäure in Wasser und Kohlendioxid. Kohlendioxid ist das Gas, das bei dieser Reaktion entsteht. Die Gesamtgleichung für diese Reaktion lautet wie folgt:
(NH4)2CO3 + 2 HCl -> 2 NH4Cl + H2CO3
H2CO3 -> H2O + CO2
Die Nettoionengleichung für diese Reaktion lautet:
CO3 2- + 2 H+ -> H2O + CO2
