Ammoniumbifluorid (NH5F2) ist eine chemische Verbindung. Es löst sich in Wasser und bildet Flusssäure. Es kann Glas angreifen und Metalle korrodieren.
| Name der IUPAC | Wasserstoffammoniumfluorid |
| Molekularformel | [NH4] [HF2] |
| CAS-Nummer | 1341-49-7 |
| Synonyme | Ammoniumsäurefluorid, Ammoniumhydrofluorid, Ammoniumdifluorid, Ammoniumhydrogendifluorid, Ammoniumhydrogendifluorid |
| InChI | InChI=1S/F2H.H3N/c1-3-2;/h;1H3/q-1;/p+1 |
Eigenschaften von Ammoniumbifluorid
Ammoniumbifluorid-Formel
Die Formel für Ammoniumbifluorid lautet [NH4][HF2] oder [NH4]F·HF. Dies weist darauf hin, dass die Verbindung ein Ammoniumkation ([NH4]+) und ein Bifluorid- oder Wasserstoff(difluorid)-Anion ([HF2]−) enthält. Die Formel kann auch als NH5F2 geschrieben werden, was die Anzahl der Atome jedes Elements in der Verbindung angibt.
Ammoniumbifluorid Molmasse
Die Molmasse von Ammoniumdifluorid beträgt 57,044 g/mol. Sie wird durch Addition der Atommassen der Elemente in der Formel berechnet: (14,007 + 4 × 1,008) + (2 × 18,998) = 57,044 g/mol.
Siedepunkt von Ammoniumbifluorid
Der Siedepunkt von Ammoniumdifluorid beträgt 240 °C (464 °F; 513 K). Die Verbindung zersetzt sich jedoch vor Erreichen dieser Temperatur und setzt Ammoniak und Fluorwasserstoffgase frei 1 . Daher hat Ammoniumdifluorid keinen echten Siedepunkt.
Ammoniumbifluorid Schmelzpunkt
Der Schmelzpunkt von Ammoniumdifluorid beträgt 126 °C (259 °F; 399 K). Dies ist die Temperatur, bei der die feste Verbindung flüssig wird. Der Schmelzpunkt hängt von der Stärke der intermolekularen Kräfte zwischen den Molekülen der Verbindung ab.
Dichte von Ammoniumbifluorid g/ml
Die Dichte von Ammoniumdifluorid beträgt 1,50 g/ml. Es ist die Masse der Verbindung pro Volumeneinheit. Die Dichte kann gemessen werden, indem man die Masse einer Probe durch ihr Volumen dividiert. Die Dichte eines Stoffes hängt von seiner molekularen Struktur und Verpackung ab.
Molekulargewicht von Ammoniumbifluorid
Das Molekulargewicht von Ammoniumdifluorid beträgt 57,044 g/mol. Dies entspricht der Molmasse der Verbindung. Mithilfe des Molekulargewichts kann die Anzahl der Mol einer Substanz in einer bestimmten Masse oder einem bestimmten Volumen berechnet werden.
Struktur von Ammoniumbifluorid
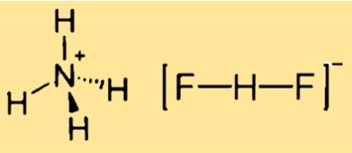
Die Struktur von Ammoniumdifluorid ist kubisch und ähnelt der CsCl-Struktur. Dies bedeutet, dass die Verbindung ein Kristallgitter mit einer kubischen Elementarzelle aufweist, in der jedes Ammoniumkation von vier Fluoridzentren in einem Tetraeder umgeben ist und jedes Difluoridanion linear ist. Die Struktur kann durch ein dreidimensionales Modell oder ein zweidimensionales Diagramm dargestellt werden.
Löslichkeit von Ammoniumbifluorid
Die Löslichkeit von Ammoniumdifluorid in Wasser beträgt 63 g/100 ml bei 20 °C. Das bedeutet, dass sich bei dieser Temperatur 63 Gramm der Verbindung in 100 Milliliter Wasser lösen können. Die Löslichkeit hängt von der Polarität und der Fähigkeit zur Wasserstoffbindung der Verbindung und des Lösungsmittels ab.
| Aussehen | Farblose Kristalle oder weiße Kristalle |
| Spezifische Dichte | 1,50 |
| Farbe | Farblos |
| Geruch | Leicht würzig, würzig |
| Molmasse | 57,044 g/Mol |
| Dichte | 1,50 g/cm3 |
| Fusionspunkt | 126 °C (259 °F; 399 K) |
| Siedepunkt | 240 °C (464 °F; 513 K) (zersetzt sich) |
| Blitzpunkt | Nicht brennbar |
| Löslichkeit in Wasser | 63g/100ml (20°C) |
| Löslichkeit | In Alkohol schwer löslich, in flüssigem Ammoniak unlöslich |
| Dampfdruck | Nicht verfügbar |
| Wasserdampfdichte | Nicht verfügbar |
| pKa | Nicht verfügbar |
| pH-Wert | Nicht verfügbar |
Sicherheit und Gefahren von Ammoniumbifluorid
Ammoniumdifluorid ist eine giftige und ätzende Chemikalie, die Ihnen schaden kann, wenn Sie sie verschlucken, einatmen oder berühren. Es kann zu schweren Verbrennungen und Augenschäden, Nasenbluten, Husten, pfeifenden Atemgeräuschen, Kurzatmigkeit, Übelkeit, Erbrechen und Appetitlosigkeit führen. Beim Erhitzen kann außerdem Fluorwasserstoff freigesetzt werden, dessen Einatmen sehr gefährlich ist. Sie sollten den Kontakt mit dieser Chemikalie vermeiden und beim Umgang damit Schutzhandschuhe, Kleidung, Augen- und Gesichtsschutz tragen. Wenn Sie dem Kontakt ausgesetzt sind, sollten Sie ihn sofort mit Wasser abspülen und einen Arzt aufsuchen. Sie sollten auch kontaminierte Kleidung waschen, bevor Sie sie erneut verwenden.
| Gefahrensymbole | T, C |
| Sicherheitsbeschreibung | S26, S36/37/39, S45 |
| UN-Identifikationsnummern | UN 1727 (fest), UN 2817 (Lösung) |
| HS-Code | 2826.19 |
| Gefahrenklasse | 8 |
| Verpackungsgruppe | II |
| Toxizität | Oraler LD50 (Ratte) = 200 mg/kg |
Methoden zur Synthese von Ammoniumbifluorid
Zur Herstellung von Ammoniumdifluorid, einem anorganischen Salz, werden unterschiedliche Methoden angewendet. Einige der gängigen Methoden sind:
- Dampfphasenverfahren: Dieses Verfahren beinhaltet die Reaktion von Ammoniakgas und Fluorwasserstoffgas bei hohen Temperaturen und hohem Druck. Das Produkt ist ein trockenes und reines Ammoniumdifluorid-Pulver. Allerdings erfordert diese Methode eine aufwendige Ausrüstung und hohe Investitionen.
- Flüssigphasenmethode: Bei dieser Methode werden wässrige Lösungen von Ammoniak und Fluorwasserstoff oder Ammoniumfluorid und Flusssäure bei mäßiger Temperatur und mäßigem Druck umgesetzt. Das Produkt ist ein feuchter, weniger reiner Ammoniumdifluoridkristall. Diese Methode wird häufig verwendet, weil sie einfach ist, das Produkt jedoch von schlechter Qualität ist und dazu neigt, Feuchtigkeit aufzunehmen und zu verklumpen.
- Neutralisationsmethode: Bei dieser Methode wird eine ungesättigte Lösung von Ammoniumfluorid und Flusssäure umgesetzt, gefolgt von der Zugabe einer Ammoniaklösung, um die überschüssige Flusssäure zu neutralisieren. Das Produkt ist ein relativ reiner und stabiler Ammoniumdifluoridkristall. Diese Methode kann die Produktqualität verbessern und die Umweltbelastung verringern.
Verwendung von Ammoniumbifluorid
Ammoniumdifluorid ist ein anorganisches Salz, das in verschiedenen Branchen vielfältig eingesetzt wird. Einige der häufigsten Verwendungszwecke sind:
- Ätzen von Glas: Ammoniumdifluorid kann die Siliziumdioxidkomponente von Glas angreifen und Muster oder Designs auf der Oberfläche erzeugen. Es kann auch Flecken und Rost von Glaswaren entfernen.
- Metallverarbeitung: Ammoniumdifluorid kann bei bestimmten Metallen als Komplexbildner wirken und die Qualität und das Aussehen der Galvanisierung verbessern. Es kann auch Oxide und Ablagerungen von Metalloberflächen entfernen.
- Keramikproduktion: Wird als Flussmittel bei der Herstellung keramischer Glasuren und Emails verwendet. Es kann auch den Schmelzpunkt und die Viskosität bestimmter Keramikmaterialien senken.
- Organische Synthese: Wird als Katalysator oder Reagenz bei bestimmten organischen Reaktionen wie Fluorierung, Entschützung und Spaltung verwendet.
- Mineralverdauung: Wird auch als starkes Fluorierungsmittel verwendet, um bestimmte Mineralien und feuerfeste Oxide in lösliche Fluoride umzuwandeln. Dies kann die Gewinnung von Edelmetallen aus Erzen erleichtern.
Fragen:
F: Wie hoch ist die Schüttdichte von Ammoniumbifluoridsalzen?
A: Die Schüttdichte von Ammoniumdifluoridsalzen beträgt 1,5 g/cm3.
F: Wofür wird Ammoniumbifluorid verwendet?
A: Ammoniumdifluorid wird für verschiedene Zwecke verwendet, beispielsweise zum Ätzen von Glas, zur Metallverarbeitung, zur Keramikproduktion, zur organischen Synthese und zum Mineralaufschluss.
F: Wie ätzt man Glas mit Ammoniumbifluorid?
A: Um Glas mit Ammoniumdifluorid zu ätzen, müssen Sie eine Salzlösung in Wasser herstellen und diese mit einem Pinsel oder einer Schablone auf die Glasoberfläche auftragen. Die Lösung reagiert mit der Silica-Komponente des Glases und erzeugt Muster oder Designs. Nach dem Ätzen müssen Sie das Glas mit Wasser abspülen und trocknen.
F: Ist Ammoniumbifluorid auf Chromrädern sicher?
A: Ammoniumdifluorid ist auf Chromrädern nicht sicher, da es das Metall angreifen und die Oberfläche beschädigen kann. Bei Kontakt mit der Haut oder den Augen kann es außerdem zu schweren Verbrennungen und Augenschäden kommen. Bei Chromfelgen sollten Sie auf den Einsatz von Ammoniumdifluorid verzichten und stattdessen einen geeigneten Reiniger verwenden.
F: Wie lange ist Ammoniumbifluorid haltbar?
A: Die Haltbarkeit von Ammoniumdifluorid hängt von den Lagerbedingungen und der Produktreinheit ab. Im Allgemeinen ist es mehrere Jahre haltbar, wenn es an einem kühlen, trockenen und gut belüfteten Ort in einem dicht verschlossenen Behälter gelagert wird. Allerdings kann es Feuchtigkeit aus der Luft aufnehmen und mit der Zeit Klumpen oder Kuchen bilden. Sie sollten das Aussehen und die Qualität des Produkts überprüfen, bevor Sie es verwenden.
F: Ist Ammoniumbifluorid eine Säure?
A: Ammoniumdifluorid ist keine Säure, sondern ein Salz, das ein Ammoniumkation ([NH4]+) und ein Difluorid oder Wasserstoff(difluorid)-Anion ([HF2]−) enthält. Es kann jedoch als Säure-Base-Verbindung wirken, da es beim Erhitzen oder Auflösen in Wasser Fluorwasserstoff (HF), eine starke Säure, freisetzen kann.
