Ammoniumbicarbonat ist eine weiße kristalline Verbindung, die beim Backen als Backmittel verwendet wird. Beim Erhitzen wird Kohlendioxid freigesetzt, was zu leichten und lockeren Backwaren führt.
| IUPAC-Name | Ammoniumbicarbonat |
| Molekularformel | NH4HCO3 |
| CAS-Nummer | 1066-33-7 |
| Synonyme | Saures Ammoniumcarbonat; Backammoniak; Ammoniumsalz der Kohlensäure (1:1); Ammoniumhydrogencarbonat |
| InChI | InChI=1S/CH2O3.H3N/c2-1(3)4;/h(H2,2,3,4);1H3 |
Bitte beachten Sie, dass der angegebene InChI-Wert eine vereinfachte Darstellung ist und möglicherweise nicht vollständig ist.
Eigenschaften von Ammoniumbicarbonat
Ammoniumbicarbonat-Formel
Die chemische Formel für Ammoniumbicarbonat lautet NH4HCO3. Es besteht aus einem Ammoniumion (NH4+) und einem Bicarbonation (HCO3-). Diese Formel stellt die Zusammensetzung der Verbindung dar und weist auf das Vorhandensein von Ammonium- und Bicarbonatgruppen hin.
Molmasse von Ammoniumbicarbonat
Die Molmasse von Ammoniumhydrogencarbonat wird durch Addition der Atommassen seiner Bestandteile berechnet. Für Ammoniumhydrogencarbonat (NH4HCO3) beträgt die Molmasse etwa 79,06 Gramm pro Mol. Dieser Wert ist für verschiedene chemische Berechnungen und Umrechnungen wichtig.
Siedepunkt von Ammoniumbicarbonat
Ammoniumhydrogencarbonat hat keinen ausgeprägten Siedepunkt, da es beim Erhitzen in gasförmige Produkte zerfällt. Der Zersetzungsprozess beginnt jedoch etwa bei 60 bis 70 Grad Celsius. Bei steigender Temperatur zerfällt die Verbindung in Ammoniak (NH3), Wasser (H2O) und Kohlendioxid (CO2).
Schmelzpunkt von Ammoniumbicarbonat
Der Schmelzpunkt von Ammoniumhydrogencarbonat liegt bei etwa 41 bis 60 Grad Celsius. Beim Erhitzen erfährt die Verbindung eine Sublimation und geht direkt vom Feststoff in den gasförmigen Zustand über, ohne die flüssige Phase zu durchlaufen.
Dichte von Ammoniumbicarbonat g/ml
Die Dichte von Ammoniumhydrogencarbonat beträgt bei Raumtemperatur etwa 1,59 Gramm pro Milliliter (g/ml). Dieser Wert stellt die Masse der Verbindung pro Volumeneinheit dar. Die Dichte von Ammoniumhydrogencarbonat beeinflusst sein Verhalten in verschiedenen Anwendungen und seine Löslichkeit in verschiedenen Lösungsmitteln.
Molekulargewicht von Ammoniumbicarbonat
Das Molekulargewicht von Ammoniumhydrogencarbonat beträgt etwa 79,06 Gramm pro Mol. Dieser Wert ergibt sich aus der Addition der Atommassen der in der Verbindung vorhandenen Elemente (Stickstoff, Wasserstoff, Kohlenstoff und Sauerstoff). Das Molekulargewicht ist entscheidend für die Berechnung der Menge an Ammoniumhydrogencarbonat, die für chemische Reaktionen benötigt wird.
Struktur von Ammoniumbicarbonat
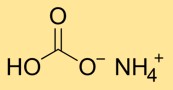
Ammoniumhydrogencarbonat hat eine Kristallstruktur, die aus Ammonium- (NH4+) und Bicarbonat-Ionen (HCO3-) besteht. Das Ammoniumion entsteht durch die Kombination eines Stickstoffatoms und vier Wasserstoffatomen, während das Bicarbonation aus einem Kohlenstoffatom besteht, das an drei Sauerstoffatome gebunden ist.
Löslichkeit von Ammoniumbicarbonat
Ammoniumhydrogencarbonat ist in Wasser sehr gut löslich. Es löst sich leicht in wässrigen Lösungen und setzt Ammoniumionen und Bicarbonationen frei. Allerdings nimmt seine Löslichkeit mit der Temperatur ab. Es ist in Alkohol schlecht löslich und in den meisten organischen Lösungsmitteln unlöslich.
| Aussehen | weißes kristallines Pulver |
| Spezifisches Gewicht | 1.586 g/cm³ |
| Farbe | Farblos |
| Geruch | Ammoniakgeruch |
| Molmasse | 79,06 g/Mol |
| Dichte | 1,59 g/ml |
| Fusionspunkt | 41-60°C |
| Siedepunkt | Zersetzt |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Löslich |
| Löslichkeit | In Wasser löslich; in Alkohol schlecht löslich |
| Dampfdruck | Unzutreffend |
| Wasserdampfdichte | Unzutreffend |
| pKa | Unzutreffend |
| pH-Wert | ~7 |
Bitte beachten Sie, dass es sich bei den angegebenen Werten um Näherungswerte handelt, die je nach Faktoren wie Reinheit und Umgebungsbedingungen variieren können.
Sicherheit und Gefahren von Ammoniumbicarbonat
Ammoniumhydrogencarbonat birgt bestimmte Sicherheitsaspekte und Gefahren. Es kann bei Kontakt oder Einatmen Augen, Haut und Atemwege reizen. Direkte Einwirkung kann zu Beschwerden, einschließlich Brennen, führen. Es ist wichtig, vorsichtig mit der Masse umzugehen und geeignete persönliche Schutzausrüstung wie Handschuhe und Schutzbrillen zu verwenden. Darüber hinaus kann Ammoniumhydrogencarbonat beim Erhitzen schädliches Ammoniakgas freisetzen, sodass in solchen Situationen eine ausreichende Belüftung erforderlich ist. Die Verbindung ist nicht brennbar und hat keinen spezifischen Flammpunkt. Die ordnungsgemäße Lagerung, Kennzeichnung und Einhaltung von Sicherheitsprotokollen sind unerlässlich, um die mit der Handhabung und Verwendung von Ammoniumhydrogencarbonat verbundenen Risiken zu minimieren.
| Gefahrensymbole | Xi (irritierend) |
| Sicherheitsbeschreibung | – Kontakt mit Augen, Haut und Einatmen vermeiden.\n- Geeignete persönliche Schutzausrüstung verwenden.\n- Bei der Handhabung für ausreichende Belüftung sorgen.\n- Ordnungsgemäß lagern und Behälter kennzeichnen.\n – Sicherheitsprotokolle befolgen. |
| UN-Identifikationsnummern | Unzutreffend |
| HS-Code | 28369990 |
| Gefahrenklasse | Nicht klassifiziert |
| Verpackungsgruppe | Nicht klassifiziert |
| Toxizität | Geringe Toxizität; Reizt Augen, Haut und Atemwege. |
Bitte beachten Sie, dass die bereitgestellten Informationen allgemeiner Natur sind und möglicherweise nicht alle Aspekte der Sicherheit und Gefahren von Ammoniumhydrogencarbonat abdecken. Für eine umfassende Orientierung ist es wichtig, sich auf spezifische Sicherheitsdatenblätter und Vorschriften zu beziehen.
Methoden zur Synthese von Ammoniumbicarbonat
Es gibt verschiedene Methoden zur Synthese von Ammoniumhydrogencarbonat.
Eine gängige Methode beinhaltet die Reaktion zwischen gasförmigem Ammoniak (NH3) und Kohlendioxid (CO2) in einer wässrigen Lösung. Bei diesem Verfahren blasen Sie die beiden Gase direkt in das Wasser und das Wasser bildet eine Ammoniumhydrogencarbonatlösung. Anschließend konzentrieren und kristallisieren Sie die Lösung, um die feste Verbindung zu erhalten.
Ein anderer Ansatz ist die Reaktion zwischen Ammoniak und Kohlendioxid in einem Lösungsmittel wie Methanol oder Ethanol. Die Reaktion findet unter Druck und bei hoher Temperatur statt, was zur Bildung von Ammoniumhydrogencarbonat-Kristallen führt.
Durch die Behandlung von Ammoniumcarbonat mit Kohlendioxid entstehen Ammoniumbicarbonat und Wasser. Ammoniumcarbonat reagiert, ob in fester Form oder in Lösung, mit Kohlendioxid unter Bildung von Ammoniumbicarbonat.
Zur Synthese von Ammoniumhydrogencarbonat kann Ammoniak mit Kohlensäure kombiniert werden. Kohlensäure entsteht durch Auflösen von Kohlendioxid in Wasser und durch Zugabe von Ammoniak zur resultierenden Kohlensäurelösung entsteht Ammoniumhydrogencarbonat.
Stellen Sie sicher, dass die Ammoniumhydrogencarbonat-Synthese in einem gut belüfteten Bereich stattfindet, da während der Reaktionen Ammoniakgas freigesetzt wird. Befolgen Sie die entsprechenden Sicherheitsvorkehrungen und Handhabungsprotokolle, um einen sicheren und effizienten Syntheseprozess zu gewährleisten.
Verwendung von Ammoniumbicarbonat
Ammoniumhydrogencarbonat findet vielfältige Verwendung in unterschiedlichen Branchen und Anwendungen. Hier sind einige seiner häufigsten Verwendungszwecke:
- Backen: Ammoniumhydrogencarbonat wird als Backmittel beim Backen verwendet, insbesondere für Kekse, Cracker und andere Backwaren. Beim Erhitzen wird Kohlendioxid freigesetzt, wodurch eine leichte, knusprige Konsistenz entsteht.
- Ammoniakproduktion: Ammoniumhydrogencarbonat dient als Zwischenverbindung bei der Ammoniakproduktion. Es kann in Ammoniak und Kohlendioxid zerfallen, die dann abgetrennt und für verschiedene Zwecke verwendet werden können.
- Landwirtschaft: Landwirte nutzen es als Stickstoffquelle in Düngemitteln, um wichtige Nährstoffe für das Pflanzenwachstum bereitzustellen. Pflanzen nehmen es dank seiner Wasserlöslichkeit leicht auf.
- pH-Kontrolle: Industrien verwenden Ammoniumhydrogencarbonat, um den pH-Wert in Prozessen wie der Wasseraufbereitung, der Farbstoffherstellung und der Pigmentproduktion anzupassen.
- Feuerlöscher: Einige Trockenpulver-Feuerlöscher verwenden diese Verbindung als Feuerlöscher. Es erstickt die Flammen und stört den Verbrennungsprozess.
- Reinigungsmittel: Einige Branchen verwenden es als Reinigungsmittel, um Schmutz, Fett und Verunreinigungen von Oberflächen zu entfernen.
- Textil- und Lederindustrie: Beim Färben und Bedrucken von Textilien und Lederwaren trägt Ammoniumhydrogencarbonat zur Fixierung von Farbstoffen und zur Verbesserung der Farbechtheit bei.
- Pharmazeutische Anwendungen: Es findet in bestimmten pharmazeutischen Formulierungen Anwendung als Puffermittel oder Inhaltsstoff in medizinischen Tabletten.
Die vielfältigen Anwendungen von Ammoniumhydrogencarbonat unterstreichen seine Vielseitigkeit und Nützlichkeit in zahlreichen Branchen, darunter Backwaren, Landwirtschaft, pH-Kontrolle, Brandbekämpfung und verschiedene Herstellungsprozesse.
Fragen:
F: Ist Ammoniumbicarbonat schädlich für Sie?
A: Ammoniumhydrogencarbonat kann schädlich sein, wenn es in großen Mengen eingenommen oder eingeatmet wird, und Reizungen der Atemwege und der Haut verursachen. Es sollte mit entsprechenden Vorsichtsmaßnahmen gehandhabt und verwendet werden.
F: Wie trennt man Ammoniumcarbonat von Ammoniumbicarbonat?
A: Ammoniumcarbonat kann durch Erhitzen der Mischung vom Ammoniumhydrogencarbonat getrennt werden, da Ammoniumbicarbonat in Ammoniak, Kohlendioxid und Wasser zerfällt und Ammoniumcarbonat zurückbleibt.
F: Wie berechnet man den pH-Wert von Ammoniumbicarbonat in Wasser?
A: Der pH-Wert von Ammoniumhydrogencarbonat in Wasser kann mithilfe der Henderson-Hasselbalch-Gleichung berechnet werden: pH = pKa + log([A-]/[HA]), wobei pKa die Säuredissoziationskonstante und [A-]/[ HA] stellt das Verhältnis der konjugierten Base zur Säure dar.
F: Wie stelle ich den pH-Wert des Ammoniumbicarbonatpuffers ein?
A: Der pH-Wert eines Ammoniumhydrogencarbonatpuffers kann durch Zugabe entweder einer starken Säure zur Senkung des pH-Werts oder einer starken Base zur Erhöhung des pH-Werts eingestellt werden, während das entsprechende Verhältnis von Ammoniumbicarbonat zu seiner konjugierten Base beibehalten wird.
F: Ist Ammoniumbicarbonat in Lebensmitteln sicher?
A: Ammoniumhydrogencarbonat gilt allgemein als sicher (GRAS) für die Verwendung in Lebensmitteln, muss jedoch gemäß den gesetzlichen Richtlinien und in angemessenen Mengen verwendet werden.
F: Was ist ein Ammoniumbicarbonatpuffer?
A: Ammoniumhydrogencarbonatpuffer ist eine Lösung, die Ammoniumhydrogencarbonat und seine konjugierte Base (oder Säure) enthält und zur Aufrechterhaltung eines stabilen pH-Werts in verschiedenen biochemischen und biologischen Anwendungen verwendet wird.
F: Wie groß ist die Molekülmasse von Ammoniumbicarbonat?
A: Die Molekularmasse von Ammoniumhydrogencarbonat beträgt etwa 79,06 g/mol.
F: Wie hoch ist die Massenprozentzusammensetzung von Wasserstoff in NH4HCO3?
A: Die Massenprozentzusammensetzung von Wasserstoff in NH4HCO3 beträgt etwa 6,57 %.
F: Ist NH4HCO3 eine Säure oder eine Base?
A: NH4HCO3 kann je nach Kontext sowohl als Säure als auch als Base wirken. Es kann ein Proton (H+) abgeben, um als Säure zu wirken, oder ein Proton aufnehmen, um als Base zu wirken.
F: Wie heißt die Verbindung mit der Formel NH4HCO3?
A: Die Verbindung mit der Formel NH4HCO3 heißt Ammoniumhydrogencarbonat.
F: Ist NH4HCO3 ionisch oder kovalent?
A: NH4HCO3 gilt als ionische Verbindung, da in seiner Struktur das Ammoniumion (NH4+) und das Hydrogencarbonat-Ion (HCO3-) vorhanden sind.
