Ammoniumacetat ist eine Verbindung, die in verschiedenen Industriezweigen verwendet wird. Es fungiert als Quelle für Acetationen und spielt eine Rolle bei chemischen Reaktionen und der organischen Synthese.
| IUPAC-Name | Ammoniumacetat |
| Molekularformel | C2H7NO2 |
| CAS-Nummer | 631-61-8 |
| Synonyme | Ammoniumsalz der Essigsäure, Ammoniumethanoat, Ammoniumessigsäure, Essigsäure, Ammoniumsalz |
| InChI | InChI=1S/C2H4O2.H3N/c1-2(3)4;/h1H3,(H,3,4);1H3 |
Eigenschaften von Ammoniumacetat
Ammoniumacetat-Formel
Die Formel für das Ammoniumsalz der Essigsäure lautet C2H7NO2. Es besteht aus zwei Kohlenstoffatomen, sieben Wasserstoffatomen, einem Stickstoffatom und zwei Sauerstoffatomen.
Molmasse von Ammoniumacetat
Die Molmasse des Ammoniumsalzes der Essigsäure wird durch Addition der Atommassen seiner Bestandteile berechnet. Das sind etwa 77,0825 Gramm pro Mol.
Siedepunkt von Ammoniumacetat
Das Ammoniumsalz der Essigsäure hat einen Siedepunkt von etwa 117 Grad Celsius. Bei dieser Temperatur vollzieht die Verbindung einen Phasenwechsel von flüssig zu gasförmig.
Ammoniumacetat Schmelzpunkt
Der Schmelzpunkt des Ammoniumsalzes der Essigsäure liegt bei etwa 114 Grad Celsius. Dies ist die Temperatur, bei der die feste Verbindung in den flüssigen Zustand übergeht.
Dichte von Ammoniumacetat g/ml
Die Dichte des Ammoniumsalzes der Essigsäure beträgt etwa 1,17 Gramm pro Milliliter. Es ist ein Maß für die Masse pro Volumeneinheit der Verbindung.
Molekulargewicht von Ammoniumacetat
Das Molekulargewicht des Ammoniumsalzes der Essigsäure beträgt etwa 77,0825 Gramm pro Mol. Es ist die Summe der Atomgewichte aller in der Verbindung vorhandenen Atome.
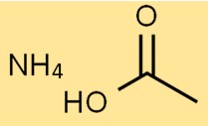
Struktur von Ammoniumacetat
Die Struktur des Ammoniumsalzes der Essigsäure besteht aus einem NH4+-Ion und einem CH3COO–Ion. Das NH4+-Ion ist positiv geladen, während das CH3COO–Ion negativ geladen ist.
Löslichkeit von Ammoniumacetat
Das Ammoniumsalz der Essigsäure ist in Wasser gut löslich. Es löst sich leicht in Wasser und bildet eine klare, farblose Lösung. Die Löslichkeit des Ammoniumsalzes der Essigsäure in Wasser beruht auf seiner Fähigkeit, Wasserstoffbrückenbindungen mit Wassermolekülen zu bilden.
| Aussehen | Weißer kristalliner Feststoff |
| Spezifisches Gewicht | 1,17 g/ml |
| Farbe | Farblos |
| Geruch | Geruchlos |
| Molmasse | 77,0825 g/Mol |
| Dichte | 1,17 g/ml |
| Fusionspunkt | 114°C |
| Siedepunkt | 117°C |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | sehr gut wasserlöslich |
| Löslichkeit | Löslich in Wasser, Essigsäure, Ethanol |
| Dampfdruck | Nicht verfügbar |
| Wasserdampfdichte | Nicht verfügbar |
| pKa | 4,75 |
| pH-Wert | Ungefähr 6,0-7,0 |
Sicherheit und Gefahren von Ammoniumacetat
Das Ammoniumsalz der Essigsäure birgt bei korrekter Handhabung nur minimale Sicherheitsrisiken. Seine Verwendung gilt in verschiedenen Anwendungen allgemein als sicher. Allerdings müssen wie bei jeder Chemikalie Vorsichtsmaßnahmen getroffen werden. Vermeiden Sie das Einatmen von Stäuben oder Dämpfen, da dies zu Reizungen der Atemwege führen kann. Bei der Arbeit mit Ammoniumsalz der Essigsäure wird das Tragen geeigneter persönlicher Schutzausrüstung, einschließlich Handschuhen und Schutzbrille, empfohlen. Bei versehentlichem Verschlucken oder Kontakt mit Augen oder Haut mit reichlich Wasser spülen und gegebenenfalls einen Arzt aufsuchen. Lagern Sie das Ammoniumsalz der Essigsäure an einem kühlen, trockenen Ort, entfernt von unverträglichen Substanzen. Befolgen Sie die ordnungsgemäßen Handhabungs- und Entsorgungsverfahren, um die Sicherheit zu gewährleisten.
| Gefahrensymbole | Keiner |
| Sicherheitsbeschreibung | Geringe Toxizität |
| UN-Identifikationsnummern | Nicht reguliert |
| HS-Code | 2915.29.10 |
| Gefahrenklasse | Ammoniumsalz der Essigsäure ist nicht klassifiziert |
| Verpackungsgruppe | Unzutreffend |
| Toxizität | Geringe Toxizität |
Methoden zur Synthese von Ammoniumacetat
Es gibt verschiedene Methoden zur Synthese des Ammoniumsalzes der Essigsäure. Ein üblicher Ansatz besteht darin , Essigsäure mit einer wässrigen Lösung von Ammoniumcarbonat zu mischen. Bei der Reaktion zwischen ihnen entstehen Ammoniumsalz und Essigwasser. Diese Methode erfordert die Kontrolle von Temperatur und Druck während der Reaktion.
Bei einer anderen Methode geben Chemiker unter Rühren nach und nach Essigsäure zu einer Ammoniaklösung, bis der gewünschte pH-Wert erreicht ist. Dieser Neutralisationsprozess wandelt Essigsäure in das Ammoniumsalz der Essigsäure um. Bei dieser Reaktion sind sorgfältiges Mischen und pH-Kontrolle unerlässlich.
Verwenden Sie Ammoniumhydroxid, um das Ammoniumsalz der Essigsäure zu synthetisieren, indem Sie es mit Essigsäure kombinieren, was zur Bildung des Ammoniumsalzes der Essigsäure und Wasser führt. Überwachen Sie den Fortschritt dieser Reaktion, bis sie abgeschlossen ist.
Mischen Sie Essigsäureanhydrid mit Ammoniumhydroxid oder Ammoniak, um das Ammoniumsalz der Essigsäure herzustellen. Die Reaktion zwischen diesen Reagenzien führt zur Bildung eines Ammoniumsalzes der Essigsäure.
Denken Sie daran, dass es wichtig ist, die Synthese des Ammoniumsalzes der Essigsäure in einem gut belüfteten Bereich durchzuführen und entsprechende Sicherheitsmaßnahmen zu befolgen. Achten Sie während des gesamten Syntheseprozesses auf die ordnungsgemäße Handhabung und Lagerung der Chemikalien.
Verwendung von Ammoniumacetat
Das Ammoniumsalz der Essigsäure findet aufgrund seiner vielseitigen Eigenschaften vielfältige Anwendungen in verschiedenen Branchen. Hier sind einige häufige Verwendungszwecke:
- Das Ammoniumsalz der Essigsäure puffert Lösungen und sorgt für einen stabilen pH-Wert in chemischen und biologischen Labors.
- Analytische Methoden wie Chromatographie und Massenspektrometrie nutzen das Ammoniumsalz der Essigsäure als Reagenz zur Ionisierung und Trennung von Verbindungen.
- Die Molekularbiologie nutzt das Ammoniumsalz der Essigsäure, um bei Reinigungsverfahren DNA auszufällen und so Verunreinigungen und Verunreinigungen zu entfernen.
- Das Ammoniumsalz der Essigsäure nimmt an vielen chemischen Reaktionen teil und fungiert als Quelle für Acetationen in der organischen Synthese, bei Veresterungsreaktionen und bei katalytischen Prozessen.
- In der Landwirtschaft dient das Ammoniumsalz der Essigsäure als Stickstoffquelle in Düngemitteln und fördert das Pflanzenwachstum und die Pflanzenentwicklung.
- Die Textilindustrie verwendet das Ammoniumsalz der Essigsäure zum Färben und Bedrucken von Stoffen und verbessert dadurch die Farbechtheit, indem sie die Farbstoffe im Stoff fixiert.
- Die Lebensmittelindustrie genehmigt das Ammoniumsalz der Essigsäure als Lebensmittelzusatzstoff, der den Säuregehalt reguliert, um den pH-Wert verschiedener Lebensmittelprodukte zu kontrollieren.
- Bei chemischen Analysetechniken wie der HPLC (Hochleistungsflüssigkeitschromatographie) erleichtert das Ammoniumsalz der Essigsäure die Trennung und den Nachweis von Verbindungen.
Insgesamt ist das Ammoniumsalz der Essigsäure eine vielseitige Verbindung mit Einsatzmöglichkeiten, die von Laboranwendungen bis hin zur Landwirtschaft und Lebensmittelindustrie reichen. Seine einzigartigen Eigenschaften machen es zu einem wichtigen Bestandteil verschiedener Prozesse und Produkte.
Fragen:
F: Wie viele Wasserstoffatome enthält ein Molekül Ammoniumacetat, NH4C2H3O2?
A: Ein Molekül Ammoniumsalz der Essigsäure (NH4C2H3O2) enthält vier Wasserstoffatome.
F: Ist Ammoniumacetat löslich?
A: Ja, das Ammoniumsalz der Essigsäure ist wasserlöslich.
F: Wie lautet die Formel für Ammoniumacetat?
A: Die Formel für das Ammoniumsalz der Essigsäure lautet NH4C2H3O2.
F: Ist Ammoniumacetat wasserlöslich?
A: Ja, das Ammoniumsalz der Essigsäure ist wasserlöslich.
F: Wie bereitet man 1M Ammoniumacetat zu?
A: Um 1 M Ammoniumsalz der Essigsäure herzustellen, lösen Sie die entsprechende Menge Ammoniumacetat in Wasser, um eine Konzentration von 1 Mol pro Liter (M) zu erhalten.
F: Wie viele Mol Ionen werden insgesamt freigesetzt, wenn 0,624 Mol Ammoniumacetat in Wasser gelöst werden?
A: Wenn 0,624 Mol Ammoniumsalz der Essigsäure in Wasser gelöst werden, werden insgesamt 1,248 Mol Ionen (NH4+ und C2H3O2-) freigesetzt.
F: Wie hoch ist das genaue Molekulargewicht von Ammoniumacetat (NH4OAc)?
A: Das genaue Molekulargewicht des Ammoniumsalzes der Essigsäure (NH4OAc) beträgt etwa 77,0825 Gramm pro Mol.
F: Wie stellt man 5M Ammoniumacetat her?
A: Um 5 M Ammoniumsalz der Essigsäure herzustellen, lösen Sie die entsprechende Menge Ammoniumacetat in Wasser, um eine Konzentration von 5 Mol pro Liter (M) zu erreichen.
F: Wie hoch ist der pKa-Wert von Essigsäure und der pKb-Wert von Ammoniumhydroxid?
A: Der pKa-Wert von Essigsäure beträgt etwa 4,75 und der pKb-Wert des Ammoniumsalzes der Essigsäure beträgt etwa 4,25.
