Was ist Ammoniak?
Ammoniak oder NH3 ist ein farbloses, stechendes Gas aus Stickstoff und Wasserstoff, das in der Industrie häufig als Kältemittel, Reinigungsmittel und Düngemittel verwendet wird.
| IUPAC-Name | Ammoniak |
| Molekularformel | NH3 |
| CAS-Nummer | 7664-41-7 |
| Synonyme | Azan, Stickstofftrihydrid, Hartshorn-Alkohol |
| InChI | InChI=1S/NH3/c1-2 |
Eigenschaften von Ammoniak
Lewis-Struktur für Ammoniak
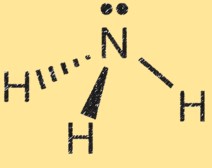
Die Lewis-Struktur von Ammoniak (NH3) zeigt die Anordnung der Elektronen im Molekül. In einer Lewis-Struktur stellen Punkte Elektronen dar und Linien stellen Bindungen zwischen Atomen dar.
Die Lewis-Struktur von Ammoniak zeigt das Stickstoffatom, umgeben von drei Wasserstoffatomen und einem Elektronenpaar, das sich die Stickstoff- und Wasserstoffatome teilen. Dies stellt die kovalenten Bindungen im Molekül dar. Das Stickstoffatom hat fünf Valenzelektronen und die Wasserstoffatome haben jeweils ein Valenzelektron. In der Lewis-Struktur von Ammoniak bildet das Stickstoffatom drei Einfachbindungen mit den Wasserstoffatomen und verfügt über ein ungeteiltes Elektronenpaar.
Ammoniakformel
Die chemische Formel für Ammoniak ist NH3. Die Formel besagt, dass jedes Ammoniakmolekül drei Wasserstoffatome und ein Stickstoffatom enthält. Die Formel stellt die Zusammensetzung des Stoffes dar und liefert wichtige Informationen über seine Eigenschaften und sein Verhalten.
NH3 Molmasse
Die Molmasse eines Stoffes ist die Masse eines Mols des Stoffes und wird in Gramm pro Mol ausgedrückt. Die Molmasse von Ammoniak (NH3) beträgt 17,0307 g/mol. Das bedeutet, dass ein Mol Ammoniak eine Masse von 17,0307 Gramm hat. Die Molmasse einer Substanz ist wichtig für die Bestimmung der Molzahl in einer bestimmten Probe und kann zur Bestimmung der Formelmasse einer Verbindung verwendet werden.
Siedepunkt von Ammoniak
NH3 hat einen Siedepunkt von -33,34 °C (-28,012 °F). Der Siedepunkt eines Stoffes ist die Temperatur, bei der sein Dampfdruck dem Atmosphärendruck entspricht und er beginnt, sich von einer Flüssigkeit in einen Gaszustand umzuwandeln. Der Siedepunkt von NH3 ist im Vergleich zu anderen Chemikalien relativ niedrig, was es zu einem nützlichen Kältemittel in Kühl- und Kühlsystemen macht.
NH3 Schmelzpunkt
NH3 hat einen Schmelzpunkt von -77,73 °C (-107,87 °F). Der Schmelzpunkt eines Stoffes ist die Temperatur, bei der er vom festen in den flüssigen Zustand übergeht. Der niedrige Schmelzpunkt von NH3 macht es zu einem nützlichen Kältemittel, da es leicht von einem Gas zu einer Flüssigkeit kondensiert werden kann und so Wärme absorbieren kann, wenn es seinen Zustand ändert.
NH3-Dichte g/ml
Die Dichte einer Substanz ist die Masse einer Probe pro Volumeneinheit. Die Dichte von NH3 beträgt 0,769 g/ml. Das bedeutet, dass ein Milliliter NH3 eine Masse von 0,769 Gramm hat. Die Dichte einer Substanz kann zur Bestimmung der in einem bestimmten Volumen vorhandenen Materiemenge verwendet werden und ist eine wichtige Eigenschaft für das Verständnis, wie sich eine Substanz in verschiedenen Zuständen verhält.
Molekulargewicht von NH3
Das Molekulargewicht einer Substanz ist die Summe der Atomgewichte aller Atome in einem einzelnen Molekül der Substanz. Das Molekulargewicht von NH3 (NH3) beträgt 17,0307 g/mol. Dies bedeutet, dass ein NH3-Molekül ein Molekulargewicht von 17,0307 Gramm pro Mol hat. Das Molekulargewicht einer Substanz ist wichtig für die Bestimmung der Molzahl in einer bestimmten Probe und kann zur Bestimmung der Formelmasse einer Verbindung verwendet werden.
NH3-Struktur
NH3 ist ein Molekül, das aus drei Wasserstoffatomen und einem Stickstoffatom besteht. Das Stickstoffatom ist über eine kovalente Bindung mit den Wasserstoffatomen verbunden und das Molekül hat die Form einer trigonalen Pyramide. Die Bindungswinkel im Molekül betragen etwa 107°. NH3 ist ein polares Molekül, das heißt, es hat ein positives und ein negatives Ende und wird häufig als Lösungsmittel und Reagenz bei chemischen Reaktionen verwendet.
| Aussehen | Farbloses Gas |
| Spezifisches Gewicht | 0,59 (Luft = 1) |
| Farbe | Farblos |
| Geruch | Scharfer und starker Geruch |
| Molmasse | 17,0307 g/Mol |
| Dichte | 0,769 g/ml |
| Fusionspunkt | -77,73°C |
| Siedepunkt | -33,34°C |
| Blitzpunkt | Nicht anwendbar (Gas) |
| Löslichkeit in Wasser | Sehr löslich |
| Löslichkeit | Löslich in Wasser und den meisten organischen Lösungsmitteln |
| Dampfdruck | 50,7 kPa bei 20°C |
| Wasserdampfdichte | 0,59 (Luft = 1) |
| pKa | 4,75 |
| pH-Wert | 11,6 (gesättigte Lösung) |
Sicherheit und Gefahren von Ammoniak
NH3 ist ein hochgiftiges und ätzendes Gas, das bei unsachgemäßer Handhabung die menschliche Gesundheit und die Umwelt ernsthaft schädigen kann. NH3 kann schwere Verätzungen der Augen, der Haut und der Atemwege verursachen und bei Einatmen in hohen Konzentrationen auch tödlich sein. Darüber hinaus ist NH3 sehr reaktiv und kann sich entzünden oder explodieren, wenn es mit bestimmten Chemikalien oder Materialien in Kontakt kommt.
Bei der Handhabung und Arbeit mit NH3 ist es wichtig, Sicherheitsvorkehrungen zu treffen. Dazu gehört das Tragen von Schutzkleidung wie Handschuhen, Schutzbrillen und einer Gesichtsmaske sowie die Gewährleistung einer ausreichenden Belüftung, um das Einatmen des Gases zu vermeiden. Es ist außerdem wichtig, NH3 in gut belüfteten Bereichen, entfernt von Wärmequellen und anderen brennbaren Materialien, zu lagern. Bei NH3-Exposition ist es wichtig, kontaminierte Kleidung auszuziehen und die betroffene Stelle mit reichlich Wasser abzuspülen. Suchen Sie sofort einen Arzt auf, wenn Symptome einer Exposition auftreten.
| Gefahrensymbole | T+, N |
| Sicherheitsbeschreibung | Umweltgefährlich, gesundheitsschädlich beim Einatmen, reizend |
| AN-Kennungen | UN 1005 |
| HS-Code | 2814.1 |
| Gefahrenklasse | 2.3 |
| Verpackungsgruppe | II |
| Toxizität | Hochgiftige und tödliche Dosis (Inhalation) – 33-66 ppm |
Methoden der Ammoniaksynthese
Es gibt verschiedene Methoden zur Synthese von Ammoniak, darunter das Haber-Verfahren, das Ostwald-Verfahren und das Birkeland-Eyde-Verfahren.
Das Haber-Verfahren, auch Haber-Bosch-Verfahren genannt, ist die am weitesten verbreitete Methode zur industriellen Synthese von Ammoniak. Dabei reagiert Stickstoffgas aus der Luft mit Wasserstoffgas an einem Eisenkatalysator zu Ammoniak. Die Reaktion findet unter hohem Druck (ca. 150 Atmosphären) und bei einer Temperatur von 450–500 °C statt. Das Haber-Verfahren ist sehr effizient, produziert große Mengen Ammoniak mit hoher Ausbeute und wird als Hauptquelle für Ammoniak für die Herstellung von Düngemitteln und anderen Chemikalien verwendet.
Der Ostwald-Prozess, auch als Stickstofffixierungsprozess bekannt, ist eine ältere Methode der Ammoniaksynthese, bei der Stickstoffgas zu Stickoxid oxidiert und anschließend Stickoxid mit mehr Stickstoffgas zu Ammoniak umgesetzt wird. Dieses Verfahren ist weniger effizient und wurde weitgehend durch das Haber-Verfahren ersetzt.
Der Birkeland-Eyde-Prozess, auch Plasmaprozess genannt, ist eine neuere Methode der Ammoniaksynthese, bei der eine Plasmaentladung verwendet wird, um Stickstoff- und Wasserstoffgase zu dissoziieren und Ammoniak zu bilden. Dieses Verfahren befindet sich noch in der Entwicklungsphase und wurde noch nicht umfassend für den industriellen Einsatz übernommen.
Zusammenfassend ist das Haber-Verfahren die am häufigsten verwendete Methode zur Ammoniaksynthese, während das Ostwald-Verfahren und das Birkeland-Eyde-Verfahren ältere oder weniger verbreitete Methoden sind.
Verwendung von Ammoniak
Ammoniak ist eine vielseitige Chemikalie mit vielfältigen Einsatzmöglichkeiten in Industrie und Landwirtschaft. Zu den Hauptverwendungszwecken von Ammoniak gehören:
- Düngemittelproduktion: Ammoniak ist der Hauptbestandteil der Stickstoffdüngerproduktion und steigert die Ernteerträge und verbessert die Bodenfruchtbarkeit.
- Kühlung: Industrie- und Haushaltskühlsysteme verwenden Ammoniak als Kältemittel, einschließlich Kühl- und Gefrierschränke.
- Reinigung: Haushaltsreiniger enthalten oft Ammoniak, da es Fett und Schmutz lösen kann.
- Pharmazeutika: Bei der Herstellung verschiedener pharmazeutischer Produkte wie Antazida und Hustensäften wird Ammoniak als Rohstoff verwendet.
- Textilproduktion: Beim Färben und Bedrucken von Textilien sowie bei der Herstellung synthetischer Fasern wird Ammoniak verwendet.
- Abfallbehandlung: Bei der Abwasserbehandlung und Geruchsbekämpfung aus Kläranlagen kommt Ammoniak zum Einsatz.
- Flammschutzmittel: Ammoniak wirkt als Flammschutzmittel bei der Herstellung von Materialien wie Kunststoffen, Gummi und anderen.
- Öl- und Gasproduktion: Die Öl- und Gasindustrie verwendet Ammoniak zur Herstellung verschiedener Chemikalien, darunter Tenside und Demulgatoren.
Zusammenfassend lässt sich sagen, dass Ammoniak eine vielseitige Chemikalie ist, die in verschiedenen Branchen und Anwendungen vielfältig eingesetzt werden kann, darunter Landwirtschaft, Kühlung, Reinigung, Pharmazeutik, Textilproduktion, Abfallbehandlung, Flammschutzmittel sowie Öl- und Gasproduktion.
Fragen:
Ist Ammoniak eine Säure oder eine Base?
Ammoniak gilt als Base. In wässrigen Lösungen löst es sich unter Bildung von Hydroxidionen (OH-) auf und wirkt als schwache Base. Ammoniak hat einen basischen (alkalischen) pH-Wert, der normalerweise bei etwa 11 liegt. Ammoniaklösungen können Säuren neutralisieren und so Salz und Wasser bilden, was eines der charakteristischen Merkmale einer Base ist. Bei chemischen Reaktionen kann Ammoniak auch als Nukleophil wirken und an Reaktionen teilnehmen, bei denen Amide gebildet werden, die Derivate von Ammoniak sind und die für Amine und Amide charakteristische Stickstoff-Kohlenstoff-Bindung enthalten.
Ist Ammoniak polar?
Ja, Ammoniak ist polar. Es hat eine gekrümmte Molekülgeometrie mit einem zentralen Stickstoffatom, das von drei Wasserstoffatomen umgeben ist. Diese Form erzeugt ein permanentes Dipolmoment, wobei sich das positive Ende des Dipols an den Wasserstoffatomen und das negative Ende am Stickstoffatom befindet. Die polare Natur von Ammoniak ermöglicht es ihm, sich in polaren Lösungsmitteln wie Wasser aufzulösen, was eine Eigenschaft polarer Moleküle ist. Die polare Natur von Ammoniak ermöglicht es ihm auch, an Wasserstoffbrückenbindungen teilzunehmen, einer Art intermolekularer Kraft, die zwischen polaren Molekülen auftritt. Diese Wasserstoffbrückenbindung kann zu höheren Siede- und Schmelzpunkten führen als bei unpolaren Molekülen ähnlicher Größe.
