Allylchlorid ist eine klare, brennbare Flüssigkeit mit stechendem Geruch. Es wird bei der Herstellung verschiedener organischer Verbindungen und als Lösungsmittel verwendet. Es kann für den Menschen schädlich sein, wenn es eingeatmet oder eingenommen wird.
| Name der IUPAC | 3-Chlorprop-1-en |
| Molekularformel | C3H5Cl |
| CAS-Nummer | 107-05-1 |
| Synonyme | 2-Propenylchlorid, 3-Chlorpropen, Chlorpropen, Allylchlorid, 3-Chlor-1-propen, 1-Chlor-2-propen |
| InChI | InChI=1S/C3H5Cl/c1-2-3-4/h2H,1,3H2 |
Eigenschaften von Allylchlorid
Allylchlorid-Formel
Die chemische Formel für Allylchlorid lautet C3H5Cl. Es ist eine klare, farblose Flüssigkeit mit stechendem Geruch. Die Struktur von Allylchlorid besteht aus einem Propenmolekül, an dessen zweites Kohlenstoffatom ein Chloratom gebunden ist. Es ist ein wichtiges Zwischenprodukt bei der Herstellung verschiedener organischer Verbindungen wie Epoxide, Allylamine und Allylalkohole.
Molmasse von Allylchlorid
Die Molmasse von 3-Chlorpropen beträgt 76,53 g/mol. Dies wird durch Addition der Atomgewichte von Kohlenstoff, Wasserstoff und Chlor berechnet, die jeweils 12,01 g/mol, 1,01 g/mol und 35,45 g/mol betragen. Die Molmasse ist eine wichtige Eigenschaft einer chemischen Verbindung, da sie zur Berechnung der Stoffmenge in einer bestimmten Masse verwendet wird.
Siedepunkt von Allylchlorid
Der Siedepunkt von 3-Chlorpropen beträgt 46,05 °C (114,9 °F). Dieser ist im Vergleich zu anderen organischen Verbindungen relativ gering, was 3-Chlorpropen zu einer flüchtigen Substanz macht. Der niedrige Siedepunkt macht 3-Chlorpropen auch für industrielle Prozesse nützlich, da es leicht verdampft und zur Reinigung kondensiert werden kann.
Schmelzpunkt von Allylchlorid
Der Schmelzpunkt von 3-Chlorpropen beträgt -136 °C (-213 °F). Dies ist eine sehr niedrige Temperatur und bedeutet, dass 3-Chlorpropen bei Raumtemperatur in flüssiger Form vorliegt. Wenn 3-Chlorpropen jedoch auf sehr niedrige Temperaturen abgekühlt wird, kann es zu einer weißen kristallinen Form erstarren.
Dichte von Allylchlorid g/ml
Die Dichte von 3-Chlorpropen beträgt 0,950 g/ml. Das bedeutet, dass 3-Chlorpropen dichter ist als Wasser, das eine Dichte von 1 g/ml hat. Die hohe Dichte von 3-Chlorpropen macht es nützlich, es von anderen Substanzen mit geringerer Dichte, wie z. B. Wasser, zu trennen.
Molekulargewicht von Allylchlorid
Das Molekulargewicht von 3-Chlorpropen beträgt 76,53 g/mol. Dieser Wert wird durch Addition der Atomgewichte aller Atome im Molekül berechnet. Das Molekulargewicht ist wichtig für die Bestimmung der physikalischen und chemischen Eigenschaften einer Verbindung.
Struktur von Allylchlorid
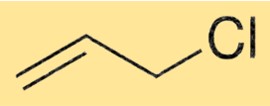
Die Struktur von 3-Chlorpropen besteht aus einem Propenmolekül, an dessen zweites Kohlenstoffatom ein Chloratom gebunden ist. Dadurch entsteht eine Vinylgruppe, eine funktionelle Gruppe in der organischen Chemie. Die Vinylgruppe ist für die Reaktivität von 3-Chlorpropen bei verschiedenen chemischen Reaktionen verantwortlich.
Löslichkeit von Allylchlorid
3-Chlorpropen ist in vielen organischen Lösungsmitteln wie Ether und Benzol löslich, in Wasser jedoch unlöslich. Die Löslichkeit von 3-Chlorpropen in verschiedenen Lösungsmitteln ist auf seine polare Natur zurückzuführen. Die Polarität von 3-Chlorpropen wird durch den Unterschied in der Elektronegativität zwischen der Kohlenstoff-Wasserstoff-Bindung und der Kohlenstoff-Chlor-Bindung bestimmt.
| Aussehen | Klare, farblose Flüssigkeit |
| Spezifische Dichte | 0,950 g/ml |
| Farbe | Farblos |
| Geruch | Acre |
| Molmasse | 76,53 g/Mol |
| Dichte | 0,950 g/ml |
| Fusionspunkt | -136°C (-213°F) |
| Siedepunkt | 46,05 °C (114,9 °F) |
| Blitzpunkt | -13°C (9°F) |
| Löslichkeit in Wasser | < 1g/L |
| Löslichkeit | Löslich in organischen Lösungsmitteln |
| Dampfdruck | 21,5 kPa bei 20°C |
| Wasserdampfdichte | 2,64 (Luft = 1) |
| pKa | 9.18 |
| pH-Wert | Nicht anwendbar (pH-Wert ist nur für wässrige Lösungen definiert) |
Sicherheit und Gefahren von Allylchlorid
3-Chlorpropen ist eine hochgiftige und ätzende Substanz. Es kann bei Kontakt schwere Hautverbrennungen und Augenschäden verursachen und beim Einatmen oder Verschlucken gesundheitsschädlich sein. Es ist außerdem leicht entflammbar und kann mit bestimmten Verbindungen heftig reagieren. Bei der Arbeit mit 3-Chlorpropen sollten entsprechende Sicherheitsvorkehrungen getroffen werden, einschließlich des Tragens von Schutzkleidung, Handschuhen und Augenschutz. Es sollte an einem kühlen, trockenen und gut belüfteten Ort, entfernt von Wärme- und Zündquellen, gelagert werden. Bei Exposition oder Verschlucken sollte sofort ein Arzt aufgesucht werden. Es ist wichtig, die richtigen Sicherheitsprotokolle zu befolgen, um Unfälle und Verletzungen beim Umgang mit 3-Chlorpropen zu vermeiden.
| Gefahrensymbole | T, C |
| Sicherheitsbeschreibung | Leicht entzündlich, giftig und ätzend. Verursacht schwere Hautverbrennungen und Augenschäden. Gesundheitsschädlich beim Einatmen oder Verschlucken. |
| UN-Identifikationsnummern | UN 1100 |
| HS-Code | 2903.39.90 |
| Gefahrenklasse | Klasse 3 (brennbare Flüssigkeiten), Klasse 6.1 (giftige Stoffe), Klasse 8 (ätzende Stoffe) |
| Verpackungsgruppe | II |
| Toxizität | LD50 = 250 mg/kg (oral, Ratte); LC50 = 1220 ppm (Inhalation, Ratte, 4h) |
Methoden zur Synthese von Allylchlorid
Es gibt verschiedene Methoden zur Synthese von 3-Chlorpropen.
Eine der gebräuchlichsten Methoden ist die Zugabe von Chlorwasserstoffgas zu Allylalkohol in Gegenwart eines Katalysators. Eine andere Methode beinhaltet die Reaktion von Propylen mit Chlorgas in Gegenwart eines Katalysators zur Bildung von 3-Chlorpropen.
Zur Herstellung von 3-Chlorpropen kann Allylalkohol mit Thionylchlorid oder Phosphortrichlorid umgesetzt werden. Bei dieser Reaktion wird der Alkohol durch eine nukleophile Substitutionsreaktion in sein entsprechendes Chlorid umgewandelt.
Eine dritte Methode zur Herstellung von 3-Chlorpropen beinhaltet die Reaktion von Allylbromid mit Natriumchlorid in Gegenwart von Kupferpulver. Chemiker verwenden diese Methode häufig, wenn sie leichten Zugang zu Allylbromid haben, aber nicht über 3-Chlorpropen verfügen.
Eine andere Methode zur Synthese von 3-Chlorpropen beinhaltet die Reaktion von Allylalkohol mit Chlorwasserstoffgas in Gegenwart eines Dehydratisierungsmittels wie Zinkchlorid. Chemiker nutzen diese Methode häufig, um 3-Chlorpropen in hoher Ausbeute und Reinheit herzustellen.
Verwendung von Allylchlorid
Aufgrund seiner einzigartigen Eigenschaften findet 3-Chlorpropen mehrere wichtige Anwendungen in verschiedenen Branchen:
- Herstellung allylischer Verbindungen: 3-Chlorpropen dient als Vorstufe für verschiedene allylische Verbindungen wie Allylalkohol, Allylamin und Allylester. Bei der Herstellung von Pharmazeutika, Parfümen und Aromen werden in der Regel Allylverbindungen eingesetzt.
- Polymerproduktion: Hersteller verwenden 3-Chlorpropen als Monomer, um verschiedene Polymere wie Poly-3-Chlorpropen und Allyldiglykolcarbonat herzustellen.
- Lösungsmittel: Wird aufgrund seines niedrigen Siedepunkts und seiner hohen Polarität als Lösungsmittel für verschiedene organische Verbindungen verwendet.
- Pestizid: Wird in der Landwirtschaft als Begasungsmittel und Bodendesinfektionsmittel zur Bekämpfung von Schädlingen und Unkräutern eingesetzt.
- Herstellung von Farbstoffen und Pigmenten: Wird zur Herstellung von Farbstoffen und Pigmenten für die Textil- und Farbenindustrie verwendet.
- Öl- und Gasindustrie: Wird auch in der Öl- und Gasindustrie als Korrosionsinhibitor, Schmiermittel und Bohrflüssigkeitszusatz verwendet.
Fragen:
F: Warum geht Allylchlorid SN1-Reaktionen ein, obwohl es ein 1°-Halogenid ist?
A: 3-Chlorpropen unterliegt SN1-Reaktionen aufgrund der Stabilität des Carbokation-Zwischenprodukts, das durch die Allylgruppe resonanzstabilisiert wird.
F: Was passiert mit Allylchlorid bei einer SN2-Reaktion?
A: Bei einer SN2-Reaktion greift das Nukleophil den Allylkohlenstoff von hinten an, was zur Umkehr der Stereochemie und zur Bildung des entsprechenden Allylalkohols oder Amins führt.
F: Ist Allylchlorid primär, sekundär oder tertiär?
A: 3-Chlorpropen ist ein primäres Halogenid.
F: Welche der folgenden Reaktionen läuft schneller ab: AcO- + 3-Chlorpropen oder MeO- + 3-Chlorpropen? A: MeO- + 3-Chlorpropen tritt aufgrund der sterischen Hinderung durch die größere Acetylgruppe des letzteren schneller auf als AcO- + 3-Chlorpropen.
F: Ist Allylchlorid ein primäres Vinylhalogenid?
A: Ja, 3-Chlorpropen ist ein primäres Vinylhalogenid.
F: Wie kann Epichlorhydrin aus Allylchlorid hergestellt werden?
A: Epichlorhydrin kann aus 3-Chlorpropen durch eine Epoxidierungsreaktion unter Verwendung einer Mischung aus Natriumhypochlorit und Salzsäure hergestellt werden.
