Aluminiumchlorid oder AlCl3 ist eine chemische Verbindung, die in verschiedenen industriellen Prozessen verwendet wird. Es fungiert als Lewis-Säure und katalysiert organische Synthese- und Polymerisationsreaktionen. Es hat auch schweißhemmende Eigenschaften in Körperpflegeprodukten.
| IUPAC-Name | Aluminiumtrichlorid |
| Molekularformel | AlCl3 |
| CAS-Nummer | 7446-70-0 |
| Synonyme | Aluminiumtrichlorid, Aluminium(III)-chlorid, Aluminium(III)-chlorid, Aluminiumchlorid, Trichloraluminium |
| InChI | InChI=1S/3ClH.Al/h3*1H;/q;;;+3/p-3 |
Aluminiumchlorid-Formel
Die chemische Formel für Aluminiumchlorid lautet AlCl3. Diese Formel gibt die Anzahl der Atome jedes Elements im Molekül an. Die Formel für Aluminiumchlorid ist wichtig, da sie zur Identifizierung des Stoffes und zur Berechnung seiner Eigenschaften dient. Die Formel wird auch in chemischen Gleichungen verwendet, um die Reaktanten und Produkte einer chemischen Reaktion darzustellen.
Molmasse von Aluminiumchlorid
Aluminiumchlorid hat eine Molmasse von 133,34 g/mol. Dieser Wert wird durch Addition der Atommasse von einem Aluminiumatom und drei Chloratomen berechnet. Die Summenformel für Aluminiumchlorid lautet AlCl3, was bedeutet, dass es ein Aluminiumatom und drei Chloratome enthält. Die Molmasse ist eine wichtige Eigenschaft von Aluminiumchlorid, da es in vielen chemischen Reaktionen und industriellen Prozessen verwendet wird. Die Molmasse wird auch verwendet, um die Menge einer Substanz zu berechnen, die in einer bestimmten Probe vorhanden ist.
Siedepunkt von Aluminiumchlorid
Der Siedepunkt von Aluminiumchlorid beträgt 180,8 °C (357,4 °F). Dieser Wert ist die Temperatur, bei der die flüssige Form von Aluminiumchlorid in den gasförmigen Zustand übergeht. Der Siedepunkt von Aluminiumchlorid ist relativ hoch, weshalb es in vielen industriellen Prozessen, die hohe Temperaturen erfordern, nützlich ist. Beispielsweise wird Aluminiumchlorid als Katalysator bei der Herstellung von Polypropylen, einem thermoplastischen Polymer, verwendet.
Schmelzpunkt von Aluminiumchlorid
Der Schmelzpunkt von Aluminiumchlorid beträgt 194 °C (381,2 °F). Dieser Wert ist die Temperatur, bei der die feste Form von Aluminiumchlorid in den flüssigen Zustand übergeht. Der Schmelzpunkt von Aluminiumchlorid ist relativ niedrig, was bedeutet, dass es leicht geschmolzen und in verschiedenen chemischen Reaktionen und industriellen Prozessen verwendet werden kann. Beispielsweise wird Aluminiumchlorid als Gerinnungsmittel in der Wasseraufbereitungsindustrie verwendet.
Dichte von Aluminiumchlorid g/ml
Die Dichte von Aluminiumchlorid beträgt 2,44 g/cm3. Dieser Wert ist die Masse an Aluminiumchlorid pro Volumeneinheit. Die Dichte von Aluminiumchlorid ist wichtig, da sie die Masse eines bestimmten Volumens der Substanz bestimmt. Die Dichte von Aluminiumchlorid wird auch zur Berechnung der Konzentration des Stoffes in einer Lösung verwendet.
Struktur aus Aluminiumchlorid
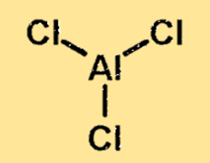
Die Struktur von Aluminiumchlorid ist ein kovalent gebundenes Molekül mit einem Aluminiumatom und drei Chloratomen. Das Aluminiumatom befindet sich im Zentrum des Moleküls, umgeben von den drei Chloratomen. Die Struktur von Aluminiumchlorid ist wichtig, da sie die physikalischen und chemischen Eigenschaften des Stoffes bestimmt.
Molekulargewicht von Aluminiumchlorid
Das Molekulargewicht von Aluminiumchlorid beträgt 133,34 g/mol. Dieser Wert ist die Summe der Atomgewichte der Atome im Molekül. Das Molekulargewicht von Aluminiumchlorid ist wichtig, da es zur Berechnung der Menge einer Substanz in einer bestimmten Probe verwendet wird. Dieser Wert wird auch zur Bestimmung der molaren Konzentration einer Lösung verwendet.
| Aussehen | Weißer bis gelber Feststoff oder Pulver |
| Spezifisches Gewicht | 2,44 g/cm3 |
| Farbe | Farblos bis hellgelb |
| Geruch | Geruchlos |
| Molmasse | 133,34 g/Mol |
| Dichte | 2,44 g/cm3 |
| Fusionspunkt | 194 °C (381,2 °F) |
| Siedepunkt | 180,8 °C (357,4 °F) |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Sehr gut wasserlöslich |
| Löslichkeit | Löslich in Ethanol, Methanol und Ether |
| Dampfdruck | 2,67 kPa bei 25 °C |
| Wasserdampfdichte | 4,45 (Luft = 1) |
| pKa | -6 |
| pH-Wert | 2,0 (10 g/L, H2O) |
Sicherheit und Gefahren von Aluminiumchlorid
Aluminiumchlorid birgt mehrere Sicherheits- und Gesundheitsrisiken. Es ist ätzend und kann bei Verschlucken oder Einatmen schwere Haut- und Augenreizungen sowie Reizungen der Atemwege und des Verdauungstrakts verursachen. Außerdem kann es bei Hautkontakt zu Verbrennungen kommen. Aluminiumchlorid ist ein starkes Oxidationsmittel und kann heftig mit Wasser reagieren, wobei Chlorwasserstoffgas freigesetzt wird. Außerdem ist es mit vielen organischen Verbindungen wie Alkoholen und Aminen unverträglich und kann mit ihnen unter Bildung gefährlicher Gase reagieren. Beim Umgang mit Aluminiumchlorid sollte geeignete Schutzausrüstung, einschließlich Handschuhe, Schutzbrille und Atemschutzmaske, getragen werden.
| Gefahrensymbole | Ätzend, schädlich |
| Sicherheitsbeschreibung | Kontakt mit Haut und Augen vermeiden. Schutzhandschuhe und Augen-/Gesichtsschutz tragen. Bei Kontakt mit viel Wasser abspülen und einen Arzt aufsuchen. Nicht einnehmen oder einatmen. In einem gut belüfteten Bereich verwenden. An einem kühlen, trockenen Ort, entfernt von unverträglichen Materialien aufbewahren. |
| UN-Identifikationsnummern | UN 1726 |
| HS-Code | 2827.32.00 |
| Gefahrenklasse | 8 |
| Verpackungsgruppe | III |
| Toxizität | Giftig bei Verschlucken oder Einatmen. Verursacht schwere Haut- und Augenreizungen. Kann Reizungen der Atemwege und des Verdauungstraktes verursachen. Kann heftig mit Wasser reagieren und Chlorwasserstoffgas freisetzen. Inkompatibel mit vielen organischen Verbindungen wie Alkoholen und Aminen und kann mit ihnen unter Bildung gefährlicher Gase reagieren. |
Methoden zur Synthese von Aluminiumchlorid
Aluminiumchlorid kann durch verschiedene Methoden wie Direktsynthese, Hydrolyse und Reaktion von Aluminium mit Chlorwasserstoff synthetisiert werden.
- Bei der Direktsynthese erfolgt die Reaktion von Aluminium mit Chlorgas bei hohen Temperaturen, normalerweise etwa 700–800 °C. Bei der Reaktion von Aluminium mit Chlorwasserstoff entsteht in der Gasphase Aluminiumchlorid, das in flüssige Form kondensiert werden kann.
- Bei der Hydrolyse handelt es sich um die Reaktion von metallischem Aluminium mit Salzsäure oder Wasser, wodurch Wasserstoffgas und Aluminiumchlorid entstehen. Die Hydrolysereaktion ist im Allgemeinen exotherm und kann bei unsachgemäßer Durchführung gefährlich sein.
- Die Reaktion von Aluminium mit Chlorwasserstoffgas ist eine weitere Methode zur Synthese von Aluminiumchlorid. Diese Reaktion findet bei Raumtemperatur statt und erzeugt Wasserstoffgas und Aluminiumchlorid.
- Eine weitere gängige Methode zur Synthese von Aluminiumchlorid ist die Reaktion von Aluminiumoxid mit Salzsäure. Bei dieser Reaktion entstehen als Produkte Aluminiumchlorid und Wasser.
- Die Reaktion von Aluminium mit einer Mischung aus Chlorgas und Kohlenmonoxid ist eine weitere Methode zur Synthese von Aluminiumchlorid. Diese Reaktion findet bei hohen Temperaturen statt und erzeugt Aluminiumchlorid und Kohlendioxid.
Insgesamt erfordert die Synthese von Aluminiumchlorid eine sorgfältige Handhabung und Kontrolle der Reaktionsbedingungen, um einen sicheren und effizienten Prozess zu gewährleisten.
Verwendung von Aluminiumchlorid
Aluminiumchlorid findet aufgrund seiner einzigartigen Eigenschaften vielfältige Einsatzmöglichkeiten in verschiedenen Branchen.
- Bei Reaktionen in der organischen Chemie, einschließlich der Herstellung von Polymeren, Pharmazeutika und Parfümen, wird üblicherweise Aluminiumchlorid als Katalysator verwendet.
- Bei der Behandlung von Trink- und Abwasser zur Entfernung suspendierter Feststoffe wird häufig Aluminiumchlorid als Koagulationsmittel eingesetzt.
- Die Produktion von Aluminium und Legierungen profitiert von der Verwendung von Aluminiumchlorid als Flussmittel, das dabei hilft, Verunreinigungen zu entfernen und den Gießprozess zu verbessern.
- In der petrochemischen Industrie dient Aluminiumchlorid als Katalysator bei der Herstellung von Benzin und anderen Kohlenwasserstoffen. Darüber hinaus wird es als Deodorant und Antitranspirant in Körperpflegeprodukten verwendet.
- Einige rezeptfreie Medikamente verwenden Aluminiumchlorid, das adstringierende Eigenschaften hat, um leichte Hautirritationen zu behandeln und Blutungen zu stoppen. Aluminiumchlorid wird auch zur Behandlung von Hyperhidrose eingesetzt, einer Erkrankung, die durch übermäßiges Schwitzen gekennzeichnet ist.
- Die Textilindustrie verwendet Aluminiumchlorid als Beizmittel, um Farbstoffe auf Stoffen zu befestigen, und es wird auch bei der Herstellung von synthetischem Kautschuk verwendet.
Insgesamt findet Aluminiumchlorid in vielen Branchen vielfältige und wichtige Verwendungsmöglichkeiten, was seine Bedeutung in der modernen Welt unterstreicht.
Fragen:
F: Welches ist der beste Vergleich zwischen 1 Mol Natriumchlorid und 1 Mol Aluminiumchlorid?
A: 1 Mol Natriumchlorid (NaCl) und 1 Mol Aluminiumchlorid (AlCl3) enthalten beide 1 Mol Chloridionen, aber Aluminiumchlorid enthält dreimal mehr Kationen als Natriumchlorid.
F: Ist Aluminiumchlorid wässrig?
A: Aluminiumchlorid kann in fester und wässriger Form vorliegen. Wenn es in Wasser gelöst wird, bildet es aufgrund der Hydrolyse des Aluminiumkations eine sehr saure Lösung.
F: Wie lautet die richtige Formel für Aluminiumchlorid?
A: Die korrekte Formel für Aluminiumchlorid ist AlCl3. Dies weist darauf hin, dass jedes Aluminiumchloridmolekül ein Aluminiumkation (Al3+) und drei Chloridanionen (Cl-) enthält.
F: Ist Aluminiumchlorid sicher?
A: Aluminiumchlorid kann gefährlich sein, wenn es nicht richtig gehandhabt wird. Es kann Haut- und Augenreizungen sowie Reizungen der Atemwege und des Verdauungstrakts verursachen und bei Verschlucken oder Einatmen giftig sein. Es sollte in einem gut belüfteten Bereich und mit geeigneter Schutzausrüstung gelagert und gehandhabt werden.
F: Wie viele Chloridionen sind in 1,50 Mol Aluminiumchlorid enthalten?
A: Da die Formel für Aluminiumchlorid AlCl3 lautet, enthält jedes Molekül drei Chloridionen. Daher enthalten 1,50 Mol Aluminiumchlorid 1,50 x 3 = 4,50 Mol Chloridionen.
