Acetylchlorid oder C2H3ClO ist eine farblose, rauchende Flüssigkeit mit stechendem Geruch. Es wird hauptsächlich als Reagenz in der organischen Synthese und als Acetylierungsmittel bei der Herstellung von Pharmazeutika und Farbstoffen verwendet.
| UPAC-Name | Acetylchlorid |
| Molekularformel | C2H3ClO |
| CAS-Nummer | 75-36-5 |
| Synonyme | Ethanoylchlorid, Essigsäurechlorid, Essigsäurechlorid, Chloracetylchlorid, AcCl |
| InChI | InChI=1S/C2H3ClO/c1-2(3)4/h1H3 |
Eigenschaften von Acetylchlorid
Molmasse von Acetylchlorid
Acetylchlorid mit der chemischen Formel C2H3ClO hat eine Molmasse von etwa 78,50 g/mol. Dies wird berechnet, indem die Atommassen jedes Atoms im Molekül addiert werden, nämlich Kohlenstoff (12,01 g/mol), Wasserstoff (1,01 g/mol), Chlor (35,45 g/mol) und Sauerstoff (16,00 g/mol). Die Molmasse von Acetylchlorid ist in stöchiometrischen Berechnungen wichtig, um die Menge an Reaktanten und Produkten in chemischen Reaktionen zu bestimmen.
Siedepunkt von Acetylchlorid
Der Siedepunkt von Acetylchlorid beträgt 51,5 °C (124,7 °F) bei normalem Atmosphärendruck. Dieser niedrige Siedepunkt und seine hohe Reaktivität bedeuten, dass Acetylchlorid im Labor mit Vorsicht gehandhabt werden muss. Es ist eine farblose, rauchende Flüssigkeit mit stechendem Geruch, die in polaren Lösungsmitteln wie Ethanol und Aceton gut löslich ist.
Schmelzpunkt von Acetylchlorid
C2H3ClO hat bei normalem Atmosphärendruck einen Schmelzpunkt von -112,1 °C (-169,8 °F). Dies macht es zu einer hochflüchtigen und reaktiven Verbindung, die eine sorgfältige Handhabung und Lagerung erfordert.
Dichte von Acetylchlorid g/ml
Acetylchlorid hat eine Dichte von 1,104 g/ml bei 25 °C (77 °F). Das bedeutet, dass C2H3ClO dichter als Wasser ist und darin versinkt. Die Dichte von C2H3ClO ist wichtig für die Bestimmung, wie viel Material in einem bestimmten Volumen gelagert werden kann, sowie für die geeigneten Sicherheitsmaßnahmen, die für die Handhabung und Lagerung des Materials erforderlich sind.
Molekulargewicht von Acetylchlorid
Das Molekulargewicht von C2H3ClO beträgt 78,50 g/mol. Dieser Wert ist wichtig für die Bestimmung der Menge an C2H3ClO, die bei chemischen Reaktionen benötigt wird, und für die Umrechnung zwischen verschiedenen Maßeinheiten.
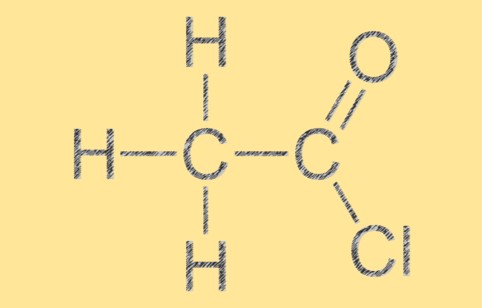
Struktur von Acetylchlorid
Acetylchlorid hat eine trigonal-planare Molekülgeometrie, wobei das Kohlenstoffatom in der Mitte von drei anderen Atomen in einer flachen dreieckigen Anordnung umgeben ist. Das Molekül hat eine C=O-Doppelbindung zwischen den Kohlenstoff- und Sauerstoffatomen und eine Einfachbindung zwischen den Kohlenstoff- und Chloratomen. Die molekulare Struktur von C2H3ClO verleiht ihm seine charakteristische Reaktivität und chemischen Eigenschaften.
Acetylchlorid-Formel
Die chemische Formel für Acetylchlorid lautet C2H3ClO und gibt die Anzahl und Art der Atome im Molekül an. Die Formel ist wichtig für stöchiometrische Berechnungen bei chemischen Reaktionen und zur Identifizierung der Verbindung im Labor. C2H3ClO wird hauptsächlich als Reagenz in der organischen Synthese und als Acetylierungsmittel bei der Herstellung von Pharmazeutika und Farbstoffen verwendet.
| Aussehen | Farblose Flüssigkeit |
| Spezifisches Gewicht | 1,104 g/ml bei 25°C |
| Farbe | Farblos |
| Geruch | Acre |
| Molmasse | 78,50 g/Mol |
| Dichte | 1,104 g/ml bei 25°C |
| Fusionspunkt | -112,1°C |
| Siedepunkt | 51,5°C |
| Blitzpunkt | -26°C |
| Löslichkeit in Wasser | Reagiert heftig mit Wasser |
| Löslichkeit | Löslich in den meisten organischen Lösungsmitteln |
| Dampfdruck | 69,7 mmHg bei 25°C |
| Wasserdampfdichte | 2,7 (Luft=1) |
| pKa | -6.3 |
| pH-Wert | Sehr sauer |
Sicherheit und Gefahren von Acetylchlorid
C2H3ClO ist ein hochreaktiver und gefährlicher Stoff, der erhebliche Risiken für die menschliche Gesundheit und Sicherheit birgt. Es handelt sich um eine ätzende und giftige Substanz, die bei Kontakt schwere Hautverbrennungen, Augenschäden und Reizungen der Atemwege verursachen kann. Acetylchlorid kann auch heftig mit Wasser reagieren und dabei Salzsäuregas erzeugen, das die Atemwege reizt. Es ist wichtig, C2H3ClO mit äußerster Vorsicht zu handhaben, geeignete persönliche Schutzausrüstung zu tragen und es nur in einem gut belüfteten Bereich zu verwenden. Auch die ordnungsgemäße Lagerung, Kennzeichnung und der Transport sind wichtig, um Unfälle zu vermeiden und einen sicheren Umgang mit diesem Stoff zu gewährleisten.
| Gefahrensymbole | Ätzend, giftig |
| Sicherheitsbeschreibung | Dämpfe nicht einatmen. Schutzhandschuhe und Augen-/Gesichtsschutz tragen. Im Brandfall einen CO2-, Trockenchemikalien- oder Schaumlöscher verwenden. |
| AN-Kennungen | UN1717 |
| HS-Code | 2915.90.9000 |
| Gefahrenklasse | 8 |
| Verpackungsgruppe | II |
| Toxizität | Sehr giftig und ätzend. Verursacht schwere Haut- und Augenverätzungen. Kann bei Einatmen oder Verschlucken tödlich sein. |
Methoden zur Synthese von Acetylchlorid
C2H3ClO entsteht durch Reaktion von Essigsäure mit Thionylchlorid, Phosphortrichlorid oder Phosphorpentachlorid. Diese Methoden beinhalten den Einsatz hochreaktiver und gefährlicher Reagenzien und sollten mit äußerster Vorsicht angewendet werden.
Die gebräuchlichste Methode zur Synthese von C2H3ClO beinhaltet die Reaktion von Essigsäure mit Thionylchlorid. Bei dieser Methode wird der Essigsäure typischerweise Thionylchlorid auf kontrollierte Weise zugesetzt, wobei die Temperatur sorgfältig kontrolliert wird, um Überhitzung und Zersetzung zu verhindern. Bei der Reaktion entstehen C2H3ClO und Schwefeldioxidgas als Nebenprodukt.
Eine weitere Methode zur Synthese von C2H3ClO beinhaltet die Reaktion von Essigsäure mit Phosphortrichlorid oder Phosphorpentachlorid. Bei dieser Methode wird Essigsäure mit Phosphortrichlorid oder Phosphorpentachlorid gemischt und erhitzt, um die Reaktion zu starten. Bei der Reaktion entstehen C2H3ClO und Phosphorsäure als Nebenprodukt.
Es ist wichtig zu beachten, dass diese Methoden den Einsatz hochreaktiver und gefährlicher Chemikalien beinhalten und nur von erfahrenen Chemikern in einem gut belüfteten Bereich mit geeigneter persönlicher Schutzausrüstung durchgeführt werden sollten. Darüber hinaus muss die Synthese von C2H3ClO unter einem Abzug durchgeführt werden, um die Belastung durch giftige und korrosive Gase zu minimieren.
Verwendung von Acetylchlorid
Acetylchlorid ist eine vielseitige chemische Verbindung, die in Industrie und Forschung vielfältige Verwendung findet. Einige der häufigsten Anwendungen von C2H3ClO sind:
- Herstellung von Arzneimitteln: Verschiedene pharmazeutische Produkte, darunter Schmerzmittel, Antibiotika und Anästhetika, verwenden bei ihrer Synthese C2H3ClO.
- Herstellung von Farbstoffen und Parfümen: Bei der Herstellung verschiedener Farbstoffe und Parfüme, beispielsweise Cumarin, das in Parfüms und Seifen verwendet wird, wird C2H3ClO verwendet.
- Polymerproduktion: Die Herstellung verschiedener Polymere wie Polycarbonat und Polyvinylchlorid, verknüpft mit C2H3ClO als Reaktant.
- Herstellung acetylierter Derivate: C2H3ClO spielt eine entscheidende Rolle bei der Herstellung acetylierter Derivate von Verbindungen wie Aminosäuren und Alkohol.
- Chemische Reaktionen: C2H3ClO weist eine hohe Reaktivität auf und ist daher ein wertvolles Reagens bei verschiedenen chemischen Reaktionen, einschließlich Acetylierungsreaktionen und Friedel-Crafts-Reaktionen.
- Laborforschung: C2H3ClO findet in der Laborforschung häufig Anwendung als Reagenz für chemische Reaktionen und als Lösungsmittel für verschiedene Verbindungen.
Es ist wichtig zu beachten, dass C2H3ClO ein gefährlicher Stoff ist und mit äußerster Vorsicht gehandhabt werden sollte. Bei der Verwendung von C2H3ClO sollten die entsprechenden Sicherheitsprotokolle und -vorschriften befolgt werden, um die mit der Handhabung und Verwendung verbundenen Risiken zu minimieren.
