Das Acetation (C2H3O2-) ist ein Anion, das aus einem Kohlenstoffatom, zwei Wasserstoffatomen und einem Sauerstoffatom besteht und in der organischen Chemie und Biochemie weit verbreitet ist.
| IUPAC-Name | Ethanoat |
| Molekularformel | C2H3O2- |
| CAS-Nummer | 127-09-3 |
| Synonyme | Essigsäureanion; Ethansäureanion; Acetat-Anion |
| InChI | InChI=1S/C2H4O2/c1-2(3)4/h1H3,(H,3,4)/p-1 |
Acetatfüller
Das Acetat-Ion ist ein Anion, das heißt, es trägt eine negative Ladung. Das Acetat-Ion wird von Essigsäure abgeleitet, einer schwachen organischen Säure, die in Wasser unter Bildung von Wasserstoffionen (H+) und Acetationen (C2H3O2-) dissoziiert. Das Acetation hat eine Ladung von -1 und ist ein häufiges Ion in biologischen Systemen und bei vielen chemischen Reaktionen.
Acetatformel
Das Acetation hat die chemische Formel C2H3O2-. Es ist ein negativ geladenes Ion, das aus zwei Kohlenstoffatomen, drei Wasserstoffatomen und zwei Sauerstoffatomen besteht. Das Acetation ist die konjugierte Base der Essigsäure , die die chemische Formel CH3COOH hat. Das Acetation bildet Salze mit positiv geladenen Ionen wie Natrium (Na+) und Calcium (Ca2+), um Natriumacetat (CH3COO-Na+) bzw. Calciumacetat (CH3COO-Ca2+) zu erzeugen. ).
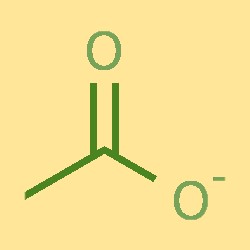
Struktur von Acetationen
Das Acetation besteht aus einem Kohlenstoffatom, zwei Wasserstoffatomen und einem Sauerstoffatom. Das Kohlenstoffatom ist an ein Sauerstoffatom und zwei Wasserstoffatome gebunden und bildet eine COH-Struktur. Das Sauerstoffatom ist außerdem an ein negativ geladenes Ion gebunden. Das Acetation hat eine trigonal-planare Form mit Bindungswinkeln von etwa 120°.
Acetat-Ionen-Molmasse
Die Molmasse des Acetat-Ions (C2H3O2) beträgt 59,04 g/mol. Sie wird durch Addition der Atomgewichte aller Atome im Ion berechnet. Die Molmasse ist wichtig für die Bestimmung der in einer Probe vorhandenen Substanzmenge.
Siedepunkt von Acetationen
Der Siedepunkt des Acetat-Ions ist nicht anwendbar, da es ein negativ geladenes Ion ist und nicht als eigenständiges Molekül existiert. Der Siedepunkt der Essigsäure, die das Acetation enthält, liegt jedoch bei 118,1 °C.
Molekulargewicht des Acetat-Ions
Das Molekulargewicht des Acetat-Ions (C2H3O2) beträgt 59,04 g/mol, was der Summe der Atomgewichte aller Atome im Ion entspricht. Das Molekulargewicht ist nützlich, um die Menge einer Substanz in einer Probe zu bestimmen.
| Aussehen | Nicht zutreffend (Ion) |
| Spezifisches Gewicht | Nicht zutreffend (Ion) |
| Farbe | Nicht zutreffend (Ion) |
| Geruch | Nicht zutreffend (Ion) |
| Molmasse | 59,04 g/Mol |
| Dichte | Nicht zutreffend (Ion) |
| Fusionspunkt | Nicht zutreffend (Ion) |
| Siedepunkt | Nicht zutreffend (Ion) |
| Blitzpunkt | Nicht zutreffend (Ion) |
| Löslichkeit in Wasser | In Wasser löslich |
| Löslichkeit | Löslich in Wasser und polaren Lösungsmitteln |
| Dampfdruck | Nicht zutreffend (Ion) |
| Wasserdampfdichte | Nicht zutreffend (Ion) |
| pKa | 4,76 |
| pH-Wert | Säure |
Sicherheit und Gefahren von Acetationen
Das Acetat-Ion gilt allgemein als sicher, da es in vielen Lebensmittel- und Getränkeprodukten ein natürlich vorkommendes Ion ist. Konzentrierte Lösungen von Essigsäure , die das Acetat-Ion enthalten, können jedoch bei Verschlucken, Einatmen oder bei Kontakt mit Haut und Augen schädlich sein und Reizungen oder Verätzungen verursachen. Beim Umgang mit konzentrierten Essigsäurelösungen sind geeignete Schutzausrüstung und Belüftung zu verwenden.
| Gefahrensymbole | Reizend |
| Sicherheitsbeschreibung | S2 – Außerhalb der Reichweite von Kindern aufbewahren. S26 – Bei Augenkontakt sofort mit viel Wasser spülen und einen Arzt konsultieren. S37 – Geeignete Handschuhe tragen. S60 – Dieses Material und sein Behälter müssen als gefährlicher Abfall entsorgt werden. |
| UN-Identifikationsnummern | UN2790 |
| HS-Code | 2915.90.90 |
| Gefahrenklasse | 8 |
| Verpackungsgruppe | III |
| Toxizität | Das Acetation gilt bei Einnahme als leicht giftig, konzentrierte Essigsäurelösungen (die Acetationen enthalten) können jedoch bei Einnahme, Einatmen oder bei Kontakt mit Haut und Augen schädlich sein. |
Methoden der Acetat-Ionen-Synthese
Die Synthese des Acetat-Ions beinhaltet normalerweise die Bildung von Essigsäure , der Ausgangsverbindung, die das Acetat-Ion enthält. Eine übliche Methode zur Synthese von Essigsäure beinhaltet die Oxidation von Ethanol mithilfe eines Oxidationsmittels wie Chromsäure. Eine andere Methode beinhaltet die Carbonylierung von Methanol unter Verwendung von Kohlenmonoxid und einem Katalysator. Essigsäure kann auch biologisch durch die Fermentation von Kohlenhydraten durch acetogene Bakterien hergestellt werden. Das Acetat-Ion kann auch durch Dissoziation von Essigsäure in einer Lösung erhalten werden, wodurch das Acetat-Ion und Wasserstoffionen freigesetzt werden. In manchen Fällen kann das Acetation auch durch die Reaktion eines Essigsäureesters mit einer starken Base erhalten werden.
Verwendung von Acetat-Ionen
Das Acetat-Ion (C2H3O2) dient in Form von Essigsäure branchenübergreifend vielfältigen Zwecken. Die Lebensmittelindustrie verwendet Essigsäure aufgrund ihres säuerlichen Geschmacks und ihrer antimikrobiellen Eigenschaften als Würzmittel und Konservierungsmittel. Die Textilindustrie verwendet Essigsäure als Bestandteil von Weichspülern und als Farbstofffixiermittel. In der chemischen Industrie dient Essigsäure als Rohstoff für die Herstellung anderer Chemikalien wie Vinylacetat, das in Klebstoffen und Beschichtungen verwendet wird. Die Pharmaindustrie verwendet Acetationen als Bestandteil von Arzneimitteln und als Puffer bei medizinischen Behandlungen. Darüber hinaus wird Celluloseacetat, eine Art Kunststoff, aus Essigsäure hergestellt und findet Anwendung in Filmen und optischen Fasern.
