Acetamid ist ein weißer kristalliner Feststoff mit leichtem Geruch. Es wird durch die Reaktion von Essigsäure mit Ammoniak synthetisiert. Es wird häufig bei der Herstellung von Kunststoffen und Arzneimitteln verwendet.
| IUPAC-Name | Ethanamid |
| Molekularformel | C2H5NO |
| CAS-Nummer | 60-35-5 |
| Synonyme | Essigsäureamid, Ethamid, Ethanamid, CH3CONH2 |
| InChI | InChI=1S/C2H5NO/c1-2(3)4/h1H3,(H2,3,4) |
Eigenschaften von Acetamid
Molmasse von Acetamid
Acetamid hat eine Molmasse von 59,07 g/mol, was der Summe der Atommassen aller Atome in einem Acetamidmolekül entspricht. Die Molmasse einer Verbindung ist nützlich, um die Anzahl der Mol der Verbindung zu bestimmen, die in einer bestimmten Probe vorhanden ist. Es wird auch verwendet, um die Massenprozentzusammensetzung der Verbindung zu berechnen.
Siedepunkt von Acetamid
Der Siedepunkt von Ethanamid liegt bei 222 °C. Dies ist die Temperatur, bei der Ethanamid vom flüssigen in den gasförmigen Zustand übergeht. Der Siedepunkt einer Substanz wird durch die Stärke ihrer intermolekularen Kräfte beeinflusst, und Ethanamid weist starke Wasserstoffbrückenbindungen zwischen seinen Molekülen auf. Daher hat es im Vergleich zu anderen Amiden einen relativ hohen Siedepunkt.
Schmelzpunkt von Acetamid
Der Schmelzpunkt von Ethanamid beträgt 82,5 °C. Dies ist die Temperatur, bei der Ethanamid vom Feststoff in den flüssigen Zustand übergeht. Der Schmelzpunkt einer Substanz wird durch die Stärke ihrer intermolekularen Kräfte beeinflusst, und im Fall von Ethanamid gibt es starke Wasserstoffbrückenbindungen zwischen seinen Molekülen. Daher ist sein Schmelzpunkt im Vergleich zu anderen Amiden relativ hoch.
Acetamiddichte g/ml
Die Dichte von Ethanamid beträgt 1,16 g/ml. Die Dichte ist die Masse eines Stoffes pro Volumeneinheit und eine nützliche physikalische Eigenschaft zur Identifizierung und Charakterisierung von Stoffen. Acetamid ist eine relativ dichte Verbindung und ihre Dichte kann in Berechnungen für verschiedene Anwendungen verwendet werden.
Molekulargewicht von Acetamid
Das Molekulargewicht von Acetamid beträgt 59,07 g/mol. Dieser Wert ist nützlich zur Bestimmung der in einer Probe vorhandenen Acetamidmenge sowie für stöchiometrische Berechnungen bei chemischen Reaktionen.
Struktur von Acetamid
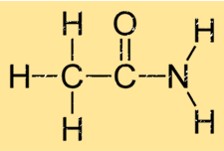
Acetamid hat eine einfache Struktur, die aus einer Carbonylgruppe (C=O) besteht, die an eine Aminogruppe (NH2) gebunden ist. Daraus ergibt sich die Summenformel C2H5NO. Die Carbonyl- und Aminogruppen sind durch ein einzelnes Kohlenstoffatom verbunden. Die Struktur von Ethanamid ermöglicht die Bildung starker Wasserstoffbrückenbindungen mit anderen Ethanamidmolekülen, was zu seinen physikalischen Eigenschaften wie Siedepunkt und Schmelzpunkt beiträgt.
Acetamid-Formel
Die chemische Formel für Ethanamid lautet CH3CONH2, was bedeutet, dass es ein Kohlenstoffatom, zwei Wasserstoffatome, ein Stickstoffatom und ein Sauerstoffatom enthält. Die Formel ist nützlich, um die in der Verbindung vorhandenen Elemente und ihre Verhältnisse zu identifizieren. Es eignet sich auch zur Bestimmung der Stöchiometrie chemischer Reaktionen mit Ethanamid.
| Aussehen | Weißer kristalliner Feststoff |
| Spezifisches Gewicht | 1,16 g/ml |
| Farbe | Farblos |
| Geruch | Leichter Geruch |
| Molmasse | 59,07 g/Mol |
| Dichte | 1,16 g/ml |
| Fusionspunkt | 82,5°C |
| Siedepunkt | 222°C |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Völlig mischbar |
| Löslichkeit | Löslich in Ethanol, Ether, Benzol und Chloroform |
| Dampfdruck | 0,000138 mmHg bei 25 °C |
| Wasserdampfdichte | 2.1 |
| pKa | 16.5 |
| pH-Wert | 6,5 – 7,5 (10 % wässrige Lösung) |
Sicherheit und Gefahren von Acetamid
Acetamid gilt als relativ sichere Verbindung, kann jedoch dennoch einige Gefahren bergen. Bei längerer Exposition kann es zu Reizungen der Haut, der Augen und der Atemwege kommen. Bei Einnahme kann es außerdem zu Magen-Darm-Reizungen und einer Depression des Zentralnervensystems kommen. Acetamid ist brennbar und kann bei Einwirkung von Hitze oder Flammen Brände verursachen. Es ist wichtig, vorsichtig mit Ethanamid umzugehen und bei der Arbeit Schutzausrüstung wie Handschuhe und Schutzbrille zu tragen. Auch eine ausreichende Belüftung und Lagerung sind notwendig, um unnötige Exposition zu vermeiden und potenzielle Risiken zu minimieren.
| Gefahrensymbole | Keiner |
| Sicherheitsbeschreibung | Vermeiden Sie eine längere Exposition. Schutzausrüstung tragen. Ausreichende Belüftung und Lagerung sind erforderlich. |
| UN-Identifikationsnummern | Unzutreffend |
| HS-Code | 29242990 |
| Gefahrenklasse | Von OSHA oder GHS nicht als gefährlich eingestuft |
| Verpackungsgruppe | Unzutreffend |
| Toxizität | LD50 (oral, Ratte): 3,8 g/kg; LC50 (Inhalation, Ratte): >20 mg/L (4-stündige Exposition) |
Acetamid-Synthesemethoden
Ammoniak oder Ammoniumsalze können mit Essigsäure reagieren, um Ethanamid zu synthetisieren, Ammoniak kann mit Acetylchlorid reagieren, um Ethanamid zu synthetisieren, und Ammoniumacetat kann einer Dehydratisierung unterzogen werden, um Ethanamid zu synthetisieren.
Bei der ersten Methode katalysiert Zinkoxid oder Kupfer die Reaktion von Essigsäure und Ammoniak oder Ammoniumsalzen zur Synthese von Ethanamid. Bei der Reaktion entstehen Ethanamid und Wasser als Nebenprodukte.
Bei der zweiten Methode reagiert eine Base wie Natriumhydroxid oder Ammoniakgas mit Acetylchlorid unter Bildung von Ethanamid. Bei der Reaktion entstehen als Nebenprodukte Ethanamid und Chlorwasserstoffgas.
Bei der dritten Methode erleichtert ein Dehydratisierungsmittel wie Schwefelsäure die Dehydratisierung von Ammoniumacetat, um Ethanamid und Wasser als Nebenprodukt zu synthetisieren.
Verwendung von Acetamid
Acetamid findet aufgrund seiner einzigartigen Eigenschaften vielfältige Einsatzmöglichkeiten in verschiedenen Branchen. Einige der häufigsten Anwendungen von Ethanamid sind:
- Lösungsmittel: Hersteller verwenden es häufig als Lösungsmittel zur Herstellung von Kunststoffen, Fasern und Harzen.
- Pharmazeutische Industrie: Wird in der pharmazeutischen Industrie als Rohstoff für die Synthese verschiedener Medikamente und auch als Stabilisator für bestimmte Antibiotika verwendet.
- Textilindustrie: Wird in der Textilindustrie als Weichmacher für synthetische Fasern wie Nylon und als Färbemittel für Baumwolle und andere Naturfasern verwendet.
- Chemische Industrie: Wird auch als chemisches Zwischenprodukt bei der Herstellung verschiedener Chemikalien wie Acrylnitril, Essigsäureanhydrid und Acrylamid verwendet.
- Lebensmittelindustrie: Wird als Aromastoff und Zutat in einigen Lebensmitteln wie Backwaren, Süßigkeiten und Eiscreme verwendet.
- Laborforschung: Wird in der Laborforschung als Lösungsmittel, Reagenz und auch als Denaturierungsmittel für Proteine verwendet.
Fragen:
F: Welches Reagenz oder welche Reagenziensequenz wandelt Acetamid in Ethylacetat um?
A: Acetamid kann in Ethylacetat umgewandelt werden, indem man es mit Ethylchlorformiat in Gegenwart einer Base wie Pyridin umsetzt. Bei der Reaktion entstehen als Nebenprodukte Ethylacetat, Kohlendioxid und Chlorwasserstoffgas.
F: Ist Acetamid eine Aminosäure?
A: Nein, Ethanamid ist keine Aminosäure. Es ist ein Derivat der Essigsäure und enthält eine funktionelle Amidgruppe (-CONH2) anstelle einer Aminogruppe (-NH2).
F: Was ist das Produkt der Reaktion von Acetamid mit HO-?
A: Die Reaktion von Acetamid mit HO- (Hydroxidion) führt zur Hydrolyse von Acetamid unter Bildung von Essigsäure und Ammoniak.
F: Wie entferne ich Acetamid-Lösungsmittel aus Kristallen?
A: Um das Ethanamid-Lösungsmittel aus den Kristallen zu entfernen, können Techniken wie Umkristallisation oder Vakuumfiltration eingesetzt werden. Bei der Umkristallisation werden die Kristalle in einem geeigneten Lösungsmittel wie Wasser gelöst und das Lösungsmittel dann langsam verdampft, um reine Kristalle zu erhalten. Bei der Vakuumfiltration werden die Kristalle unter reduziertem Druck durch Filterpapier filtriert, um etwaige Ethanamid-Lösungsmittelreste zu entfernen.
F: Hat Acetamid eine Wasserstoffbindung?
A: Ja, Ethanamid kann an der Wasserstoffbrückenbindung teilnehmen, da in seiner Molekülstruktur ein Wasserstoffbrückenbindungsakzeptor (-CO) und ein Wasserstoffbrückenbindungsdonor (-NH2) vorhanden sind.
