Ethan ist ein Kohlenwasserstoff mit der chemischen Formel C2H6. Es wird häufig als Kraftstoff verwendet und ist Bestandteil von Erdgas. Ethan hat zwei Kohlenstoffatome und sechs Wasserstoffatome.
| IUPAC-Name | Ethan |
| Molekularformel | C2H6 |
| CAS-Nummer | 74-84-0 |
| Synonyme | Diethyl, Dimethyl, Ethylhydrid, Methylmethan |
| InChI | InChI=1S/C2H6/c1-2/h1-2H3 |
Eigenschaften von Ethan
Ethan-Formel
Die chemische Formel für Ethan lautet C2H6. Dies weist darauf hin, dass jedes Ethanmolekül aus zwei Kohlenstoffatomen und sechs Wasserstoffatomen besteht. Die Formel hilft uns, die Zusammensetzung von Ethan und seine strukturelle Anordnung zu verstehen.
Molmasse von Ethan
Die Molmasse von Ethylhydrid wird durch Addition der Atommassen seiner Bestandteile berechnet. Kohlenstoff hat eine Atommasse von 12,01 g/mol und Wasserstoff hat eine Atommasse von 1,008 g/mol. Multipliziert man die Atommassen mit ihrer jeweiligen Anzahl und addiert man sie, erhält man die Molmasse von Ethylhydrid, die etwa 30,07 g/mol beträgt.
Siedepunkt von Ethan
Ethylhydrid hat einen Siedepunkt von -88,6 Grad Celsius. Dies bedeutet, dass sich Ethylhydrid bei normalem Atmosphärendruck von einer Flüssigkeit in ein Gas verwandelt, wenn es auf diese Temperatur erhitzt wird. Der Siedepunkt ist eine wichtige Eigenschaft, da er die Bedingungen bestimmt, unter denen Ethylhydrid verdampft werden kann.
Schmelzpunkt von Ethan
Der Schmelzpunkt von Ethylhydrid liegt bei -182,8 Grad Celsius. Bei Temperaturen unterhalb dieses Punktes liegt Ethylhydrid in fester Form vor. Beim Erhitzen auf diese Temperatur oder darüber erfährt Ethylhydrid einen Phasenwechsel vom festen in den flüssigen Zustand. Der Schmelzpunkt ist entscheidend für das Verständnis des physikalischen Verhaltens von Ethylhydrid bei Kühl- oder Heizprozessen.
Ethandichte g/ml
Die Dichte von Ethylhydrid beträgt bei Standardtemperatur und -druck etwa 0,55 g/ml. Die Dichte ist ein Maß für die in einem bestimmten Volumen vorhandene Masse. Im Fall von Ethylhydrid verrät es uns, wie dicht seine Moleküle gepackt sind, und gibt Aufschluss über seine physikalischen Eigenschaften.
Molekulargewicht von Ethan
Das Molekulargewicht von Ethylhydrid beträgt 30,07 g/mol. Es ist die Summe der Atommassen aller Atome in einem einzelnen Ethylhydridmolekül. Mithilfe des Molekulargewichts können wir bestimmen, wie viel Ethylhydrid in einer bestimmten Masse oder einem bestimmten Volumen vorhanden ist.
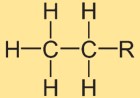
Struktur von Ethan
Die Struktur von Ethylhydrid besteht aus zwei Kohlenstoffatomen, die durch eine einzige kovalente Bindung miteinander verbunden sind. Jedes Kohlenstoffatom ist von drei Wasserstoffatomen umgeben. Die strukturelle Anordnung ist linear, wobei die Wasserstoffatome symmetrisch um die Kohlenstoff-Kohlenstoff-Bindung angeordnet sind.
Löslichkeit von Ethan
Ethylhydrid ist in Wasser nicht sehr löslich. Es ist ein unpolares Molekül, während Wasser ein polares Lösungsmittel ist. Unpolare Moleküle wie Ethylhydrid haben schwache intermolekulare Kräfte und lösen sich in polaren Lösungsmitteln nicht leicht. Ethylhydrid kann sich jedoch in anderen unpolaren Lösungsmitteln wie Hexan oder Benzol lösen.
| Aussehen | Farbloses Gas |
| Spezifisches Gewicht | 1,038 g/L |
| Farbe | N / A |
| Geruch | Geruchlos |
| Molmasse | 30,07 g/Mol |
| Dichte | 0,55 g/ml |
| Fusionspunkt | -182,8°C |
| Siedepunkt | -88,6°C |
| Blitzpunkt | -135°C |
| Löslichkeit in Wasser | Unlöslich |
| Löslichkeit | Löslich in unpolaren Lösungsmitteln |
| Dampfdruck | 46,9 psi (bei 21 °C) |
| Wasserdampfdichte | 1,52 (Luft = 1) |
| pKa | ~50 |
| pH-Wert | N / A |
Sicherheit und Gefahren von Ethan
Ethylhydrid birgt mehrere Sicherheitsaspekte und Gefahren. Es ist leicht entzündlich und kann mit Luft explosionsfähige Gemische bilden. Wenn Ethylhydrid einer Flamme oder einer Wärmequelle ausgesetzt wird, kann es sich entzünden und einen Brand oder eine Explosion verursachen. Es ist wichtig, Ethylhydrid in gut belüfteten Bereichen und fern von Zündquellen zu handhaben und zu lagern. Außerdem stellt Ethylhydrid eine Erstickungsgefahr dar, da es in geschlossenen Räumen Sauerstoff verdrängt. Das Einatmen hoher Konzentrationen von Ethylhydrid kann zu Schwindel, Übelkeit und sogar Bewusstlosigkeit führen. Um diese Risiken zu mindern, ist es wichtig, bei der Arbeit mit oder in der Nähe von Ethylhydrid geeignete persönliche Schutzausrüstung zu tragen und Sicherheitsprotokolle zu befolgen.
| Gefahrensymbole | Brennbares Gas |
| Sicherheitsbeschreibung | Von Hitze, Funken und offenen Flammen fernhalten. In gut belüfteten Bereichen verwenden. Beim Umgang mit geeigneten Vorsichtsmaßnahmen ist die Gefahr eines Brandes oder einer Explosion zu vermeiden. |
| UN-Identifikationsnummern | UN1035 |
| HS-Code | 29011000 |
| Gefahrenklasse | 2.1 (Brennbares Gas) |
| Verpackungsgruppe | Unzutreffend |
| Toxizität | Ethan gilt nicht als hochgiftig. Das Einatmen hoher Konzentrationen kann jedoch zum Ersticken führen. Bei ausreichender Belüftung verwenden und längere Exposition vermeiden. |
Ethan-Synthesemethoden
Verschiedene Methoden synthetisieren Ethylhydrid.
Eine gängige Methode ist das Dampfcracken, bei dem Kohlenwasserstoffe, meist Ethylhydrid oder schwerere Kohlenwasserstoffe, bei hohen Temperaturen (ca. 750 bis 900 °C) in Gegenwart von Wasserdampf erhitzt werden. Dieser Prozess löst Reaktionen aus, einschließlich thermischer Zersetzung und Umlagerung, wodurch Ethylhydrid, Ethylen und Propylen entstehen.
Eine andere Methode beinhaltet die katalytische Hydrierung von Acetylen , bei der Acetylengas mit Wasserstoff an geeigneten Katalysatoren wie Palladium oder Nickel reagiert und Ethylhydrid erzeugt. Diese Methode wandelt hochreaktives und potenziell gefährliches Acetylen selektiv in ein stabileres und weniger reaktives Ethylhydrid um.
Ethan kann auch durch kryogene Extraktion aus Erdgas gewonnen werden. Erdgas, hauptsächlich Methylhydrid, wird niedrigen Temperaturen und hohen Drücken ausgesetzt, um das Ethylhydrid abzutrennen und zurückzugewinnen. Erdgasaufbereitungsanlagen nutzen dieses Verfahren üblicherweise, um wertvolles Ethylhydrid für verschiedene industrielle Anwendungen zu gewinnen.
Darüber hinaus entsteht bei der Erdölraffinierung und einigen petrochemischen Prozessen Ethylhydrid als Nebenprodukt. Techniken wie Destillation oder Absorption trennen Ethylhydrid von anderen Kohlenwasserstoffströmen.
Insgesamt ermöglichen diese Synthesemethoden die Produktion von Ethylhydrid, einem entscheidenden Rohstoff für die Herstellung einer breiten Palette von Chemikalien, Kunststoffen und Kraftstoffen, der für viele Industriezweige auf der ganzen Welt von Bedeutung ist.
Verwendung von Ethan
Aufgrund seiner vielseitigen Eigenschaften findet Ethylhydrid in verschiedenen Branchen Anwendung. Hier sind einige wichtige Anwendungen von Ethylhydrid:
- Petrochemische Industrie: Ethylhydrid ist ein wesentlicher Rohstoff für die Herstellung von Ethylen, das als Grundlage für Kunststoffe, Harze und synthetische Fasern dient. Es ist ein Schlüsselelement bei der Herstellung von Polyethylen, einem der am häufigsten verwendeten Kunststoffe weltweit.
- Kraftstoff und Energie: Ethylhydrid spielt eine Rolle bei der Befeuerung und Stromversorgung bestimmter Industrieprozesse und ist Bestandteil von Erdgas. Industriebetriebe verbrennen Ethylhydrid zur Erzeugung von Wärme oder Strom und dienen als Energiequelle für Wohn-, Gewerbe- und Industrieanwendungen.
- Kühlung: In einigen Anwendungen, wie z. B. Niedertemperatursystemen, dient Ethylhydrid als Kältemittel und sorgt für effiziente Kühlfunktionen. Es bietet effiziente Kühlmöglichkeiten und ist eine Alternative zu anderen Kältemitteln mit höherer Umweltbelastung.
- Lösungsmittel: Ethylhydrid dient vor allem im Labor als unpolares Lösungsmittel. Ethylhydrid erleichtert Prozesse wie Extraktion, Reinigung und Analyse.
- Kalibriergas: Ethylhydrid dient als Komponente bei der Kalibrierung von Gasgemischen für Gasdetektoren und -analysatoren und ermöglicht die Kalibrierung und Überprüfung von Gasdetektionsgeräten.
- Aerosol-Treibmittel: Ethylhydrid fungiert in verschiedenen Produkten als Aerosol-Treibmittel und stößt bei Druckentlastung deren Inhalt aus dem Behälter aus. Es verleiht die Kraft, die zum Versprühen von Substanzen wie Kosmetika, Farben und Haushaltsprodukten erforderlich ist.
- Chemische Synthese: Ethylhydrid dient als Rohstoff für die Synthese verschiedener organischer Chemikalien, darunter Ethanol, Ethylenoxid und Vinylchlorid. Diese Chemikalien finden unter anderem bei der Herstellung von Lösungsmitteln, Kunststoffen, Reinigungsmitteln und PVC-Rohren Anwendung.
Diese vielfältigen Anwendungen unterstreichen die Bedeutung von Ethylhydrid in zahlreichen Branchen und machen es zu einem entscheidenden Element in der modernen Fertigung und im täglichen Leben.
Fragen:
F: Ist C2H6 polar oder unpolar?
A: C2H6 (Ethylhydrid) ist ein unpolares Molekül, da der Unterschied in der Elektronegativität zwischen Kohlenstoff und Wasserstoff gering ist, was zu einer gleichmäßigen Verteilung der Elektronendichte führt.
F: Wie viele Mol Kohlenstoffatome sind in 0,500 Mol C2H6 enthalten?
A: In 0,500 Mol C2H6 gibt es 1,00 Mol Kohlenstoffatome, da jedes Molekül C2H6 2 Kohlenstoffatome enthält.
F: Wie lautet die empirische Formel für C2H6?
A: Die empirische Formel für C2H6 lautet CH3, was das einfachste Verhältnis der im Molekül vorhandenen Atome darstellt.
F: Was ist C2H6?
A: C2H6 ist die chemische Formel für Ethylhydrid, ein gasförmiger Kohlenwasserstoff, der üblicherweise als Brennstoff und Bestandteil von Erdgas verwendet wird.
F: Warum hat Ethan (C2H6) keine Strukturisomere?
A: Ethylhydrid (C2H6) hat keine Strukturisomere, da seine Kohlenstoffatome durch eine Einfachbindung verbunden sind, was zu einer linearen Struktur ohne andere mögliche Anordnung führt.
F: Hat C2H6 eine Wasserstoffbrücke?
A: C2H6 (Ethylhydrid) weist keine Wasserstoffbindung auf, da ihm Wasserstoffatome fehlen, die an stark elektronegative Elemente wie Stickstoff, Sauerstoff oder Fluor gebunden sind.
F: Ist C2H6 ionisch oder kovalent?
A: C2H6 ist eine kovalente Verbindung, da sie durch die gemeinsame Nutzung von Elektronen zwischen Kohlenstoff- und Wasserstoffatomen entsteht.
F: Ist C2H6 wasserlöslich?
A: C2H6 ist in Wasser unlöslich, da es ein unpolares Molekül ist und sich in polaren Lösungsmitteln nicht leicht löst.
F: Enthält ein Gasgemisch CH4 und C2H6 im äquimolaren Verhältnis?
A: Ja, wenn die Gasmischung CH4 und C2H6 im äquimolaren Verhältnis enthält, bedeutet dies, dass die Anzahl der Mol CH4 gleich der Anzahl der Mol C2H6 in der Mischung ist.
