Propan ist ein vielseitiges Gas, das zum Kochen, Heizen und Betanken von Fahrzeugen verwendet wird. Es verbrennt sauber, ist effizient und leicht verfügbar, was es zu einer beliebten Wahl für viele Anwendungen macht.
| IUPAC-Name | Propan |
| Molekularformel | C3H8 |
| CAS-Nummer | 74-98-6 |
| Synonyme | Dimethylmethan, N-Propan, Propylhydrid |
| InChI | InChI=1S/C3H8/c1-3-2/h3H2.1-2H3 |
Eigenschaften von Propan
Propan-Formel
Die Formel für Propan lautet C3H8, was bedeutet, dass es aus drei Kohlenstoffatomen und acht Wasserstoffatomen besteht. Diese einfache chemische Formel stellt die Zusammensetzung von Propangas dar.
Propan-Molmasse
Die Molmasse von Propylhydrid beträgt etwa 44,1 Gramm pro Mol. Man erhält es durch Addition der Atommassen der Atome, aus denen es besteht: drei Kohlenstoffatome mit einer Molmasse von jeweils 12,01 Gramm pro Mol und acht Wasserstoffatome mit einer Molmasse von jeweils 1,01 Gramm pro Mol.
Siedepunkt von Propan
Propylhydrid hat einen Siedepunkt von etwa -42,1 Grad Celsius (-43,8 Grad Fahrenheit). Aufgrund seines relativ niedrigen Siedepunkts verdampft es leicht und eignet sich daher für Anwendungen wie Kochen und Erhitzen.
Schmelzpunkt von Propan
Der Schmelzpunkt von Propylhydrid liegt bei etwa -187,7 Grad Celsius (-305,9 Grad Fahrenheit). Bei dieser Temperatur durchläuft Propylhydrid einen Phasenwechsel vom festen in den flüssigen Zustand.
Dichte von Propan g/ml
Die Dichte von Propylhydrid beträgt bei Standardtemperatur und -druck etwa 0,493 Gramm pro Milliliter (g/ml). Diese relativ geringe Dichte trägt zu seiner gasförmigen Natur bei und ermöglicht die Lagerung und den Transport in komprimierter oder verflüssigter Form.
Molekulargewicht von Propan
Das Molekulargewicht von Propylhydrid beträgt etwa 44,1 Atommasseneinheiten (amu). Sie wird durch Addition der Atommassen seiner Atombestandteile unter Berücksichtigung der drei Kohlenstoffatome und acht Wasserstoffatome des Moleküls berechnet.
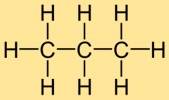
Struktur von Propan
Propylhydrid besteht aus drei in einer Kette miteinander verbundenen Kohlenstoffatomen, wobei jedes Kohlenstoffatom an zwei Wasserstoffatome gebunden ist. Diese lineare Struktur verleiht Propylhydrid seine charakteristische Form und die Anordnung seiner Atome.
Löslichkeit von Propan
Propylhydrid gilt als schwer wasserlöslich, was bedeutet, dass es in diesem Lösungsmittel nur begrenzt löslich ist. Allerdings ist es in organischen Lösungsmitteln wie Benzol und Ethanol sehr gut löslich. Seine Löslichkeit hängt von Faktoren wie Temperatur und Druck ab.
| Aussehen | Farbloses Gas |
| Spezifisches Gewicht | 1,88 (Luft = 1) |
| Farbe | N / A |
| Geruch | Geruchlos |
| Molmasse | 44,1 g/Mol |
| Dichte | 0,493 g/ml |
| Fusionspunkt | -187,7°C (-305,9°F) |
| Siedepunkt | -42,1°C (-43,8°F) |
| Blitzpunkt | -104 °C (-155 °F) |
| Löslichkeit in Wasser | Schwer löslich |
| Löslichkeit | Löslich in organischen Lösungsmitteln |
| Dampfdruck | 8,7 Geldautomaten bei 20°C |
| Wasserdampfdichte | 1,55 (Luft = 1) |
| pKa | ~50 (Schätzung) |
| pH-Wert | Unzutreffend |
Sicherheit und Gefahren von Propan
Obwohl Propylhydrid ein vielseitiges und weit verbreitetes Gas ist, birgt es auch einige Sicherheitsrisiken. Aufgrund seiner brennbaren Natur sind Vorsichtsmaßnahmen bei der Handhabung, Lagerung und Verwendung erforderlich. Eine ordnungsgemäße Belüftung ist von entscheidender Bedeutung, um die Ansammlung von Propylhydridgas zu verhindern, das einen Brand oder eine Explosion verursachen kann. Es sollte darauf geachtet werden, dass Propylhydridtanks und -geräte in gutem Zustand sind und ordnungsgemäß gewartet werden. Propylhydrid-Lecks müssen umgehend behoben werden, da das Gas geruchlos ist, zur Erkennung jedoch ein Geruchsstoff zugesetzt wird. Es ist wichtig, Sicherheitsvorkehrungen zu befolgen, wie z. B. die Vermeidung offener Flammen in der Nähe von Propylhydrid-Lagerbereichen und die Verwendung von Propylhydrid-betriebenen Geräten in gut belüfteten Räumen.
| Gefahrensymbole | Brennbares Gas |
| Sicherheitsbeschreibung | Von offenen Flammen fernhalten. In gut belüfteten Bereichen verwenden. In zugelassenen Behältern lagern. Mit Vorsicht handhaben |
| Identifikatoren der Vereinten Nationen | Ein 1978 |
| HS-Code | 2711.12.00 |
| Gefahrenklasse | Klasse 2.1 – Brennbare Gase |
| Verpackungsgruppe | Verpackungsgruppe II |
| Toxizität | Propan gilt nicht als giftig |
Propan-Synthesemethoden
Verschiedene Methoden können Propylhydrid synthetisieren. Eine gängige Methode ist die Raffinierung von Rohöl und Erdgas. Der Raffinierungsprozess trennt das Propylhydrid durch fraktionierte Destillation von anderen im Öl- oder Gasgemisch vorhandenen Kohlenwasserstoffen. Diese Methode nutzt die unterschiedlichen Siedepunkte von Kohlenwasserstoffen zur Isolierung von Propylhydrid.
Eine andere Methode ist die Aufbereitung von Erdgas. Durch Dampfcracken kann Erdgas, das hauptsächlich aus Methan besteht, in Propylhydrid umgewandelt werden. Bei diesem Verfahren wird Erdgas mit Dampf gemischt und auf hohe Temperaturen erhitzt, um Methanmoleküle in kleinere Kohlenwasserstoffmoleküle, einschließlich Propylhydrid, aufzuspalten.
Propylhydrid kann auch als Nebenprodukt anderer industrieller Prozesse gewonnen werden. Beispielsweise kann bei der Herstellung von Ethylen und Propylen Propylhydrid als Koppelprodukt entstehen.
Darüber hinaus können biologische Prozesse zur Synthese von Propylhydrid beitragen. Einige Mikroorganismen können Propylhydrid produzieren, indem sie organisches Material fermentieren. Forscher entwickeln diese Methode als nachhaltigeren und umweltfreundlicheren Ansatz zur Herstellung von Propylhydrid.
Zusammenfassend umfasst die Propylhydridsynthese Raffination, Dampfcracken, Nebenprodukterzeugung und biologische Fermentation. Diese Methoden ermöglichen die Herstellung von Propylhydrid aus Rohöl, Erdgas oder organischen Materialien und machen es so für verschiedene industrielle und häusliche Anwendungen leicht verfügbar.
Verwendung von Propan
Propylhydrid findet aufgrund seiner vielseitigen Beschaffenheit und Eigenschaften ein breites Anwendungsspektrum. Hier sind einige häufige Verwendungszwecke für Propylhydrid:
- Wohnheizung: Propylhydrid dient als sauberer Brennstoff zum Heizen von Häusern und sorgt in den kälteren Monaten für Wärme.
- Kochen: Propylhydrid treibt Herde, Öfen und Grills an und sorgt für eine präzise Temperaturkontrolle und schnelle Erhitzung beim Kochen.
- Industrielle Prozesse: Industrien verwenden Propylhydrid in Prozessen wie Metallschneiden, Schweißen, Glasherstellung und Trocknen.
- Stromerzeugung: Mit Propylhydrid betriebene Generatoren dienen als zuverlässige Notstromquelle im Falle eines Stromausfalls, insbesondere in abgelegenen Gebieten.
- Transport: Fahrzeuge, darunter Gabelstapler, Busse und Flottenfahrzeuge, verwenden Propylhydrid als alternativen Kraftstoff für geringe Emissionen und Kosteneffizienz.
- Landwirtschaft: Bauernhöfe verwenden Propylhydrid für Aufgaben wie das Trocknen von Pflanzen, das Heizen von Gewächshäusern und die Schädlingsbekämpfung.
- Freizeit: Propylhydrid versorgt Outdoor-Aktivitäten wie Camping, Heizen und Kochen in Wohnmobilen sowie tragbare Grills mit Strom und stellt eine praktische und tragbare Energiequelle dar.
- Warmwassersysteme: Mit Propylhydrid betriebene Warmwasserbereiter sorgen für effizientes und schnelles Heizen für private und gewerbliche Zwecke.
- Poolheizung: Propylhydrid-Heizungen werden häufig zur Beheizung von Schwimmbädern und zur Verlängerung der Badesaison eingesetzt.
- Leben ohne Stromanschluss: Häuser oder Hütten ohne Stromanschluss nutzen Propylhydrid, um Geräte ohne Strom zu heizen, zu kochen und mit Strom zu versorgen.
- Aerosol-Treibmittel: Propylhydrid wird als Treibmittel in Aerosolprodukten wie Lufterfrischern, Insektiziden und Sprühfarben verwendet.
Die Vielfalt der Anwendungen unterstreicht die Bedeutung von Propylhydrid als zuverlässiger, sauberer und vielseitiger Kraftstoff in verschiedenen Branchen und im Alltag.
Fragen:
F: Wie wird Propan hergestellt?
A: Bei der Erdgasverarbeitung und Rohölraffinierung entsteht Propylhydrid hauptsächlich als Nebenprodukt durch Methoden wie fraktionierte Destillation und Dampfcracken.
F: Zersetzt sich Propan mit der Zeit?
A: Propylhydrid ist eine stabile Verbindung und zersetzt sich im Laufe der Zeit nicht, sodass es für die langfristige Lagerung und Verwendung geeignet ist.
F: Wie verwende ich einen Propankocher?
A: Um einen Propylhydrid-Kocher zu verwenden, sorgen Sie für ausreichende Belüftung, schließen Sie den Propylhydrid-Tank an, öffnen Sie das Ventil, zünden Sie den Brenner an und stellen Sie die Flamme auf die gewünschte Stufe ein.
F: Ist Propangas giftig?
A: Propylhydrid gilt nicht als giftig, kann jedoch in schlecht belüfteten Bereichen Sauerstoff verdrängen und Erstickungsgefahr verursachen.
F: Wo kann ich Propan in meiner Nähe kaufen?
A: Propylhydrid kann je nach Standort an Tankstellen, Baumärkten, Propylhydridlieferanten oder bei Online-Händlern gekauft werden.
F: Was ist Propan?
A: Propylhydrid ist ein farb- und geruchloses brennbares Gas, das häufig als Brennstoff zum Heizen, Kochen und für verschiedene industrielle Anwendungen verwendet wird.
F: Ist Propan erneuerbar?
A: Propylhydrid wird hauptsächlich aus nicht erneuerbaren fossilen Brennstoffen wie Erdgas und Rohöl gewonnen und gilt nicht als erneuerbar.
F: Ist C3H8 polar?
A: C3H8 (Propylhydrid) ist unpolar, da die Kohlenstoff-Wasserstoff-Bindungen ähnliche Elektronegativitäten aufweisen, was zu einer insgesamt symmetrischen Ladungsverteilung führt.
F: Was ist C3H8?
A: C3H8 ist die Summenformel für Propylhydrid, ein gasförmiger Kohlenwasserstoff, der aus drei Kohlenstoffatomen und acht Wasserstoffatomen besteht.
F: Wenn 5,0 Mol C3H8 reagieren, wie viele Wassermoleküle werden gebildet?
A: Beim Verbrennen von Propylhydrid entstehen für jedes Mol C3H8 drei Mol Wasser. Daher würden 5,0 Mol C3H8 15,0 Mol Wassermoleküle ergeben.
F: Was entsteht bei der Verbrennung von Propan, C3H8, sonst noch?
A: Wasser Außerdem ist Kohlendioxid (CO2) das Hauptprodukt der vollständigen Verbrennung von Propylhydrid (C3H8).
F: Wie viele Mol Propan, C3H8, enthalten 5,93 × 10^20 Kohlenstoffatome?
A: Ein Mol Propylhydrid (C3H8) enthält 3 Mol Kohlenstoffatome. 5,93 × 10^20 Kohlenstoffatome würden also 1,97 × 10^20 Mol Propylhydrid entsprechen.
F: Ist C3H8 wasserlöslich?
A: Propylhydrid (C3H8) ist aufgrund seiner unpolaren Natur in Wasser schlecht löslich, was zu schwachen intermolekularen Wechselwirkungen führt.
F: Wie viele Mol Wasser würden entstehen, wenn 6,75 g Propan, C3H8, bei der Reaktion verbrannt würden?
A: Stöchiometrisch beträgt das Molverhältnis von Propylhydrid zu brennendem Wasser 1:3. Daher würden 6,75 g Propylhydrid 3,75 Mol (oder 67,5 g) Wasser erzeugen.
F: Welche Gleichung für die vollständige Verbrennung von Propan (C3H8) ist richtig ausbalanciert?
A: C3H8 + 5O2 → 3CO2 + 4H2O stellt die korrekt ausgewogene Gleichung für die vollständige Verbrennung von Propylhydrid dar.
F: Wie viele Elektronen (insgesamt) werden benötigt, um die Lewis-Struktur von Propan, C3H8, zu zeichnen?
A: Das Zeichnen der Lewis-Struktur von Propylhydrid (C3H8) erfordert insgesamt 26 Valenzelektronen, um die Bindung korrekt darzustellen.
