Oktan ist ein Kraftstoff mit hoher Oktanzahl, der in Verbrennungsmotoren verwendet wird. Es verbessert die Motorleistung, reduziert Klopfen und erhöht die Leistungsabgabe. Es wird häufig in Hochleistungsfahrzeugen und Rennwagen eingesetzt.
| IUPAC-Name | Oktan |
| Molekularformel | C8H18 |
| CAS-Nummer | 111-65-9 |
| Synonyme | n-Oktan, normales Oktan, Oktan |
| InChI | InChI=1S/C8H18/c1-3-5-7-8-6-4-2/h3-8H2.1-2H3 |
Oktaneigenschaften
Oktanzahlformel
Die Formel für Oktan lautet C8H18. Es besteht aus acht Kohlenstoffatomen und achtzehn Wasserstoffatomen. Diese Summenformel stellt die Anordnung der Atome in einem einzelnen Oktanmolekül dar.
Oktan-Molmasse
Die Molmasse von Oktan wird durch Addition der Atommassen aller Atome in seiner chemischen Formel berechnet. Die Molmasse von Oktan beträgt etwa 114,22 Gramm pro Mol. Dies ist bei verschiedenen Berechnungen wichtig, bei denen es um die Oktanmenge in einer bestimmten Probe geht.
Siedepunkt der Oktanzahl
Octan hat einen Siedepunkt von etwa 125,5 Grad Celsius (257,9 Grad Fahrenheit). Dies ist die Temperatur, bei der Oktan von der flüssigen Phase in die gasförmige Phase übergeht. Der Siedepunkt von Octan wird durch seine molekulare Struktur und intermolekulare Kräfte beeinflusst.
Oktan-Schmelzpunkt
Octan hat einen Schmelzpunkt von etwa -57 Grad Celsius (-70,6 Grad Fahrenheit). Dies ist die Temperatur, bei der Oktan vom festen in den flüssigen Zustand übergeht. Der Schmelzpunkt von Octan hängt von Faktoren wie der Molekülstruktur und zwischenmolekularen Kräften ab.
Oktanzahl g/ml
Die Dichte von Oktan beträgt etwa 0,703 Gramm pro Milliliter (g/ml). Die Dichte ist ein Maß für die Masse pro Volumeneinheit eines Stoffes. Die Dichte von Oktan ist geringer als die von Wasser, das eine Dichte von 1 g/ml hat, was darauf hindeutet, dass Oktan eine geringere Dichte als Wasser hat.
Oktan-Molekulargewicht
Das Molekulargewicht von Oktan beträgt etwa 114,22 Gramm pro Mol. Es ist die Summe der Atomgewichte aller Atome in einem Oktanmolekül. Das Molekulargewicht ist bei verschiedenen Berechnungen von entscheidender Bedeutung, beispielsweise bei der Bestimmung der für eine Reaktion benötigten Oktanmenge.
Oktanstruktur
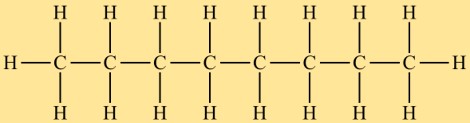
Octan gehört zur Klasse der Alkane und hat eine lineare Struktur. Es besteht aus einer Kette von acht Kohlenstoffatomen, an die Wasserstoffatome gebunden sind. Die Anordnung der Atome im Oktan ist so, dass keine verzweigte oder zyklische Struktur vorliegt.
Oktanzahl-Löslichkeit
Octan gilt als wasserunlöslich. Aufgrund seiner unpolaren Natur weist es eine geringe Löslichkeit in polaren Lösungsmitteln auf. Oktan ist jedoch in unpolaren Lösungsmitteln wie anderen Kohlenwasserstoffen, Ölen und organischen Lösungsmitteln gut löslich.
| Aussehen | Farblose Flüssigkeit |
| Spezifisches Gewicht | 0,703 g/ml |
| Farbe | Farblos |
| Geruch | Geruchlos |
| Molmasse | 114,22 g/Mol |
| Dichte | 0,703 g/ml |
| Fusionspunkt | -57 °C (-70,6 °F) |
| Siedepunkt | 125,5 °C (257,9 °F) |
| Blitzpunkt | -18°C (0°F) |
| Löslichkeit in Wasser | Unlöslich |
| Löslichkeit | Löslich in unpolaren Lösungsmitteln |
| Dampfdruck | 12,9 mmHg bei 20°C |
| Wasserdampfdichte | 3,47 (Luft = 1) |
| pKa | ~45 |
| pH-Wert | Neutral |
Oktansicherheit und Gefahren
Octan birgt bestimmte Sicherheitsrisiken, die berücksichtigt werden müssen. Es ist leicht entflammbar und kann sich leicht entzünden, was eine Brandgefahr darstellt. Octan-Dämpfe können mit Luft explosive Gemische bilden, wodurch die Gefahr von Bränden und Explosionen steigt. Es ist wichtig, mit Oktan vorsichtig umzugehen, für ausreichende Belüftung zu sorgen und Zündquellen zu vermeiden. Hautkontakt mit Octan kann zu Reizungen und Trockenheit führen. Das Verschlucken oder Einatmen von Octan kann Gesundheitsrisiken verursachen, einschließlich Reizungen der Atemwege und Auswirkungen auf das Zentralnervensystem. Es ist wichtig, Sicherheitsvorkehrungen zu befolgen, geeignete persönliche Schutzausrüstung zu verwenden und Octan von inkompatiblen Substanzen fernzuhalten.
| Gefahrensymbole | Entzündlich (F), Reizend (Xi) |
| Sicherheitsbeschreibung | Von Hitze/Funken/offenen Flammen fernhalten. In einem gut belüfteten Bereich verwenden. Kontakt mit Haut und Augen vermeiden. |
| UN-Identifikationsnummern | UN 1262 |
| HS-Code | 2901.10.10 |
| Gefahrenklasse | 3 – Brennbare Flüssigkeiten |
| Verpackungsgruppe | III |
| Toxizität | Schwach |
Octan-Synthesemethoden
Verschiedene Methoden können Octan synthetisieren. Eine gängige Methode ist die katalytische Reformierung von Erdölfraktionen wie Naphtha. Der Prozess erhitzt das Naphtha und leitet es über einen Katalysator, normalerweise Platin oder Rhenium, wodurch die Umlagerung der Kohlenwasserstoffmoleküle gefördert wird. Durch diese Umlagerung entstehen Verbindungen mit höherer Oktanzahl, insbesondere Oktanzahl.
Eine andere Methode ist die Alkylierung von Isobutan mit Butenen. Schwefelsäure oder Flusssäure erleichtern als Säurekatalysatoren die Reaktion von Isobutan, einem verzweigten Kohlenwasserstoff, mit ungesättigten Kohlenwasserstoffen (Butenen). Bei dieser Reaktion entstehen verzweigtkettige Oktanmoleküle.
Isomerisierung ist ein weiterer Ansatz zur Herstellung von Octan. Es wandelt geradkettige Kohlenwasserstoffe wie Hexan oder Heptan in verzweigtkettige Isomere um. Verschiedene Katalysatoren, darunter Zeolithe oder Platinkatalysatoren, können diesen Prozess katalysieren.
Darüber hinaus kann Oktan durch Hydrierung aromatischer Kohlenwasserstoffe wie Toluol oder Xylol unter Verwendung von Wasserstoffgas und einem geeigneten Katalysator gewonnen werden. Diese Reaktion wandelt aromatische Verbindungen in Cyclohexan um, das weiter dehydriert werden kann, um Oktan zu erzeugen.
Diese Synthesemethoden spielen eine wichtige Rolle bei der Herstellung von Oktan, das häufig als Kraftstoffkomponente in Benzin verwendet wird. Mithilfe dieser Techniken kann ein Oktan mit der gewünschten Oktanzahl erhalten werden, was optimale Leistung und Effizienz in Verbrennungsmotoren gewährleistet.
Verwendung von Oktan
Aufgrund seiner vorteilhaften Eigenschaften findet Octan in verschiedenen Branchen vielfältige Anwendung. Hier sind einige wichtige Anwendungen von Octan:
- Kraftstoff: Octan wird hauptsächlich als Kraftstoffkomponente in Benzin verwendet. Es verbessert die Oktanzahl des Kraftstoffs, was die Motorleistung verbessert, Klopfen reduziert und Motorschäden verhindert. Dies ist besonders wichtig bei Hochleistungsfahrzeugen und Rennwagen.
- Verbrennungsmotoren: Oktan ist für Verbrennungsmotoren von entscheidender Bedeutung, darunter in Autos, Motorrädern und Kleinmotoren. Es stellt die notwendige Energiequelle für den Betrieb und Antrieb von Fahrzeugen und Maschinen bereit.
- Chemische Synthese: Octan dient als Vorstufe für die Herstellung verschiedener Chemikalien. Es wird als Rohstoff für die Synthese anderer Kohlenwasserstoffverbindungen wie Alkohole, Aldehyde und Säuren verwendet.
- Laborlösungsmittel: Octan wird in Laboren als unpolares Lösungsmittel verwendet. Aufgrund seiner geringen Polarität eignet es sich zum Auflösen unpolarer Verbindungen und ermöglicht Forschern die Durchführung bestimmter Experimente und Extraktionen.
- Standardreferenz: Um Oktanzahlen zu bestimmen und die Leistung verschiedener Kraftstoffe zu vergleichen, verwenden Forscher und Experten aktiv Oktan als Referenz und Referenzverbindung. Es trägt dazu bei, Standards für die Qualität und Effizienz von Benzin und anderen Kohlenwasserstoff-Kraftstoffen festzulegen.
- Kalibrierung: Octan wird bei der Kalibrierung von Geräten wie Gaschromatographen verwendet, um genaue und präzise Messungen sicherzustellen. Seine bekannten Eigenschaften und sein gut charakterisiertes Verhalten machen es zu einem zuverlässigen Kalibrierstandard.
- Forschung und Entwicklung: Octan ist für Forschungs- und Entwicklungszwecke in der Automobil- und Kraftstoffindustrie unverzichtbar. Wissenschaftler und Ingenieure untersuchen aktiv die Eigenschaften, Verbrennungseigenschaften und Umweltauswirkungen von Oktan, um die Kraftstoffeffizienz zu verbessern, Emissionen zu reduzieren und innovative alternative Kraftstoffe zu entwickeln.
Octan treibt aktiv den Transport voran, ermöglicht die chemische Synthese, erleichtert Laborarbeiten und treibt Fortschritte in der Automobil- und Energieindustrie voran.
Fragen:
F: Welche Verbindung hat den höchsten Schmelzpunkt?
A: Al2(CO3)3.
F: Wie hoch ist die Standardbildungsenthalpie dieses C8H18(g)-Isomers?
A: Die Standardbildungsenthalpie des C8H18(g)-Isomers ist spezifisch für das jeweilige Isomer und müsste zur Bestimmung des Wertes identifiziert werden.
F: Wie groß ist die Masse in Gramm von 5,90 Mol C8H18?
A: Die Masse von 5,90 Mol C8H18 beträgt etwa 789,26 Gramm.
F: Welche Aussage vergleicht den Schmelzpunkt von Butan (C4H10) am besten mit dem von Oktan (C8H18)?
A: Octan (C8H18) hat einen höheren Schmelzpunkt als Butan (C4H10).
F: Wie heißt C8H18?
A: Der Name von C8H18 ist Oktan.
F: Was ist Oktan?
A: Oktan ist ein Alkankohlenwasserstoff mit der Summenformel C8H18. Es wird häufig als brennbarer Bestandteil in Benzin verwendet.
F: Welche Oktanzahl hat Benzin?
A: Die Oktanzahl von Benzin bezieht sich auf seine Fähigkeit, dem Klopfen während der Verbrennung zu widerstehen. Es zeigt die Klopffestigkeit des Kraftstoffs und seine Eignung für Motoren mit hoher Verdichtung an.
F: Was sind Oktanzahl und Cetanzahl?
A: Die Oktanzahl misst die Klopffestigkeit von Benzin, während die Cetanzahl die Zündfähigkeit von Dieselkraftstoff misst.
F: Was ist Oktan?
A: Die Oktanzahl ist ein numerischer Wert, der die Widerstandsfähigkeit eines Kraftstoffs gegen Klopfen während der Verbrennung angibt. Sie gibt die Fähigkeit des Kraftstoffs an, der Kompression vor der Zündung standzuhalten.
F: Wie heißt der Kohlenwasserstoff CH3(CH2)6CH3?
A: Der Name des Kohlenwasserstoffs CH3(CH2)6CH3 ist Oktan.
