Trimethylamin (TMA) ist eine Verbindung mit starkem Fischgeruch. Es kommt in Fisch, verrottenden Fischprodukten und menschlichem Schweiß vor. Dies kann zu Mundgeruch und Körpergeruch führen.
| IUPAC-Name | N,N-Dimethylmethanamin |
| Molekularformel | C3H9N |
| CAS-Nummer | 75-50-3 |
| Synonyme | TMA, Dimethylamin, Methyldimethylamin, N,N-Dimethylamin, tertiäres Methylamin, tertiäres Methylamin |
| InChI | InChI=1S/C3H9N/c1-4(2)3/h1-3H3 |
Eigenschaften von Trimethylamin
Trimethylamin-Formel
Die chemische Formel für Trimethylamin lautet C3H9N, was darauf hinweist, dass das Molekül drei Kohlenstoffatome, neun Wasserstoffatome und ein Stickstoffatom enthält. Mithilfe der Formel können das Molekulargewicht und andere Eigenschaften von Trimethylamin berechnet werden.
Molmasse von Trimethylamin
Die Molmasse von TMA beträgt 59,11 g/mol. Dieser Wert wird durch Addition der Atommassen aller im Molekül vorhandenen Atome berechnet. Die Molmasse ist ein wichtiger Parameter für chemische Berechnungen, insbesondere zur Bestimmung der Stöchiometrie und der Molzahl einer Substanz.
Siedepunkt von Trimethylamin
Der Siedepunkt von TMA beträgt -6,9 °C oder 19,6 °F. Dies ist ein relativ niedriger Siedepunkt, was bedeutet, dass die Verbindung flüchtig ist und leicht verdampfen kann. TMA kann durch Druck verflüssigt werden und wird in verschiedenen Anwendungen häufig in Gasform eingesetzt.
Schmelzpunkt von Trimethylamin
Der Schmelzpunkt von TMA beträgt -117,3 °C oder -179,1 °F. Dies ist ein sehr niedriger Schmelzpunkt, was bedeutet, dass die Verbindung bei Raumtemperatur normalerweise in flüssigem oder gasförmigem Zustand vorliegt. Es kann durch Abkühlen auf Temperaturen unterhalb seines Schmelzpunktes verfestigt werden.
Dichte von Trimethylamin g/ml
Die Dichte von TMA beträgt bei Raumtemperatur 0,692 g/ml. Dieser Wert wird verwendet, um die Masse von TMA pro Volumeneinheit zu bestimmen. Die Dichte der Verbindung ist im Vergleich zu anderen Flüssigkeiten relativ gering und damit weniger dicht als Wasser.
Molekulargewicht von Trimethylamin
Das Molekulargewicht von TMA beträgt 59,11 g/mol. Dieser Wert ist die Summe der Atomgewichte aller Atome im Molekül. Mithilfe des Molekulargewichts wird die Menge einer Substanz berechnet, die für eine bestimmte chemische Reaktion oder einen bestimmten chemischen Prozess erforderlich ist.
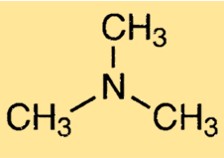
Struktur von Trimethylamin
TMA hat eine pyramidenförmige Molekülgeometrie mit einer trigonalen Pyramidenform um das Stickstoffatom. Das Molekül verfügt über ein zentrales Stickstoffatom, das an drei Methylgruppen gebunden ist. Das Stickstoffatom verfügt über ein Paar nichtbindender Elektronen, die zum charakteristischen Geruch des Moleküls beitragen.
Löslichkeit von Trimethylamin
TMA ist in Wasser und organischen Lösungsmitteln, einschließlich Ethanol, Ether und Aceton, löslich. Die Löslichkeit von TMA in Wasser beträgt 1,8 g/100 ml bei 25 °C. Aufgrund seiner polaren Natur ist die Verbindung in polaren Lösungsmitteln gut löslich und eignet sich daher für verschiedene industrielle Anwendungen.
| Aussehen | Farbloses Gas mit starkem Fischgeruch |
| Spezifisches Gewicht | 0,692 bei 25°C |
| Farbe | Farblos |
| Geruch | Starker Fischgeruch |
| Molmasse | 59,11 g/Mol |
| Dichte | 0,692 g/ml bei 25 °C |
| Fusionspunkt | -117,3°C oder -179,1°F |
| Siedepunkt | -6,9 °C oder 19,6 °F |
| Blitzpunkt | -20°C |
| Löslichkeit in Wasser | Löslich |
| Löslichkeit | Löslich in organischen Lösungsmitteln |
| Dampfdruck | 542 mmHg bei 20°C |
| Wasserdampfdichte | 2,1 bei 25°C |
| pKa | 9,79 |
| pH-Wert | Alkalisch |
Sicherheit und Gefahren von Trimethylamin
TMA birgt mehrere Sicherheitsrisiken, vor allem aufgrund seiner leichten Entflammbarkeit und seines starken Fischgeruchs. Es wird von mehreren Aufsichtsbehörden, darunter der US-amerikanischen Umweltschutzbehörde EPA, als gefährlicher Stoff eingestuft. Die Exposition gegenüber TMA kann Haut- und Augenreizungen, Atemwegsbeschwerden und Übelkeit verursachen. Es ist auch giftig, wenn es in großen Mengen eingenommen oder eingeatmet wird. Beim Umgang mit TMA sollten entsprechende Vorsichtsmaßnahmen getroffen werden, einschließlich des Tragens geeigneter Schutzausrüstung und der Gewährleistung einer ausreichenden Belüftung. Bei Exposition sollte sofort ein Arzt aufgesucht werden.
| Gefahrensymbole | Entzündlich, ätzend |
| Sicherheitsbeschreibung | Von Hitze, Funken und offenen Flammen fernhalten. Vermeiden Sie das Einatmen von Gas. Nur bei ausreichender Belüftung verwenden. Tragen Sie geeignete Schutzausrüstung. |
| UN-Identifikationsnummern | UN1083 |
| HS-Code | 29211900 |
| Gefahrenklasse | 2.1 – Brennbare Gase |
| Verpackungsgruppe | PG I |
| Toxizität | Giftig, wenn große Mengen verschluckt oder eingeatmet werden. Verursacht Haut- und Augenreizungen, Atemprobleme und Übelkeit. |
Methoden zur Synthese von Trimethylamin
Es gibt verschiedene Methoden zur Synthese von TMA, die gebräuchlichste ist jedoch die Reaktion von Formaldehyd mit Ammoniumchlorid in Gegenwart von Calciumhydroxid . Wir kennen diesen Prozess als Eschweiler-Clarke-Reaktion.
Eine andere Methode beinhaltet die Reaktion von Dimethylamin mit Formaldehyd und die anschließende Hydrierung in Gegenwart eines Katalysators. Wir nennen diese Methode die Leuckart-Wallach-Reaktion.
Bei der Frankland-Reaktion entsteht TMA, wenn bei der Reaktion von Ammoniak mit Trimethylborat Natrium- oder Kaliumhydroxid vorhanden ist.
TMA kann durch Reaktion von Methyliodid mit Ammoniak und anschließende Reduktion mit Zinkstaub hergestellt werden. Chemiker nennen diese Methode Hofmann-Abbau.
Zu anderen, weniger verbreiteten Methoden zur Synthese von TMA gehören die Reaktion von Trimethylphosphit mit Ammoniak, die Reaktion von TMA-Oxid mit Säure und die Reaktion von Trimethylaluminium mit Ammoniak .
Insgesamt erfordert die Synthese von TMA einen sorgfältigen Umgang mit reaktiven und potenziell gefährlichen Chemikalien sowie Fachwissen in der organischen Chemie.
Verwendung von Trimethylamin
Aufgrund seiner einzigartigen chemischen Eigenschaften, einschließlich seines starken und ausgeprägten Geruchs, wird TMA in verschiedenen Branchen vielfältig eingesetzt. Hier sind einige der häufigsten Anwendungen von TMA:
- Pestizidherstellung: Wird bei der Herstellung mehrerer Pestizide verwendet, darunter Chlorpyrifos und Diazinon.
- Organische Synthese: Organische Chemiker nutzen TMA häufig zur Synthese quartärer Ammoniumsalze, die aufgrund ihrer außergewöhnlichen Eigenschaften in verschiedenen Branchen breite Anwendung finden.
- Gasaufbereitung: Wird zur Entfernung saurer Gase wie Kohlendioxid und Schwefelwasserstoff aus Erdgas und Erdölprodukten verwendet.
- Pharmazeutische Industrie: Wird zur Herstellung verschiedener pharmazeutischer Produkte verwendet, darunter das Antidiabetikum Metformin und das Lokalanästhetikum Procain.
- Lebensmittelindustrie: TMA verursacht den fischigen Geruch einiger Meeresfrüchte und verleiht einigen Lebensmitteln als Aromastoff Geschmack.
- Laborforschung: Wird auch in der Laborforschung verwendet, hauptsächlich bei der Untersuchung von Proteinstrukturen.
Fragen:
F: Wie lautet die chemische Formel der Trimethylaminbase-konjugierten Säure (CH3)3N?
A: Die chemische Formel für die konjugierte Säure von TMA lautet (CH3)3NH+.
F: Der pH-Wert von 0,050 M wässrigem Trimethylamin beträgt 11,24. Wie groß ist die KB dieser Datenbank?
A: Der Kb von TMA kann anhand des pH-Werts seiner Lösung berechnet werden, der 11,24 beträgt. Der KB-Wert beträgt 1,8 x 10^-5.
F: Wie hoch ist die Anfangskonzentration von Trimethylamin im Wasser?
A: Die Anfangskonzentration von TMA in Wasser hängt von der jeweils verwendeten Lösung ab. Ohne zusätzliche Informationen ist eine Bestimmung der Ausgangskonzentration nicht möglich.
F: Ist Trimethylamin eine starke Base?
A: TMA ist eine schwache Base, da es in wässriger Lösung nur teilweise dissoziiert.
F: Ist Trimethylamin polar?
A: Ja, TMA ist aufgrund des Vorhandenseins eines Stickstoffatoms mit einem Paar freier Elektronen und drei Methylgruppen ein polares Molekül.
F: Ist Trimethylamin eine Säure oder eine Base?
A: TMA ist eine Base, weil es ein Proton von einer Säure aufnimmt, um seine entsprechende Säure zu bilden.
F: Verursacht Trimethylamin Spannungsrisskorrosion in Kohlenstoffstahl?
A: Ja, TMA kann unter bestimmten Bedingungen Spannungsrisskorrosion in Kohlenstoffstahl verursachen.
F: Wofür wird Trimethylamin in der HPLC verwendet?
A: TMA wird als mobiler Phasenzusatz in der HPLC verwendet, um die Peakform und die Trennung basischer Verbindungen zu verbessern.
F: Welche Base ist stärker, Trimethylamin oder Pyridin?
A: Pyridin ist eine stärkere Base als TMA, da das Stickstoffatom Teil eines aromatischen Rings ist, der die resultierende konjugierte Säure stabilisiert.
