Magnesiumperchlorat ist eine chemische Verbindung mit der Formel Mg(ClO4)2. Es ist ein starkes Oxidationsmittel und kann als Trockenmittel verwendet werden, um Substanzen Wasser zu entziehen.
| Name der IUPAC | Magnesiumperchlorat |
| Molekularformel | Mg(ClO4)2 |
| CAS-Nummer | 10034-81-8 |
| Synonyme | Magnesiumsalz der Perchlorsäure, Magnesium(II)perchlorat, Magnesiumdiperchlorat, UN 1475 |
| InChI | InChI=1S/2ClHO4.Mg/c2 2-1(3,4)5;/h2 (H,2,3,4,5);/q;;+2/p-2 |
Eigenschaften von Magnesiumperchlorat
Magnesiumperchlorat-Formel
Magnesiumperchlorat ist eine chemische Verbindung mit der Formel Mg(ClO4)2. Diese Verbindung besteht aus einem Magnesiumion (Mg2+) und zwei Perchlorationen (ClO4-). Es ist ein starkes Oxidationsmittel, das in verschiedenen industriellen Anwendungen eingesetzt wird, beispielsweise in Raketentreibstoffen, Feuerwerkskörpern und Leuchtraketen.
Molmasse von Magnesiumperchlorat
Die Molmasse von Mg(ClO4)2 beträgt 223,2 g/mol. Sie wird berechnet, indem die Atommassen aller in einem Mg(ClO4)2-Molekül vorhandenen Atome addiert werden. Dieser Wert ist nützlich, um die Menge an Mg(ClO4)2 zu bestimmen, die für eine bestimmte chemische Reaktion erforderlich ist.
Siedepunkt von Magnesiumperchlorat
Mg(ClO4)2 hat keinen Siedepunkt, da es sich zersetzt, bevor es seinen Siedepunkt erreicht. Bei hohen Temperaturen zersetzt es sich thermisch und setzt Sauerstoffgas frei, wobei Magnesiumchlorid und Perchlorsäure zurückbleiben.
Schmelzpunkt von Magnesiumperchlorat
Der Schmelzpunkt von Mg(ClO4)2 beträgt 202°C. Dies ist die Temperatur, bei der die feste Verbindung flüssig wird. Diese Eigenschaft ist wichtig für die Stabilität und Handhabung der Verbindung bei verschiedenen industriellen Anwendungen.
Dichte von Magnesiumperchlorat g/ml
Die Dichte von Mg(ClO4)2 beträgt bei Raumtemperatur 2,21 g/ml. Die Dichte ist die Masse pro Volumeneinheit eines Stoffes. Dieser Wert ist nützlich, um die Menge an Mg(ClO4)2 zu bestimmen, die für eine bestimmte Anwendung erforderlich ist, und auch um die Versand- und Handhabungsanforderungen abzuschätzen.
Molekulargewicht von Magnesiumperchlorat
Das Molekulargewicht von Mg(ClO4)2 beträgt 223,2 g/mol. Es ist die Summe der Atomgewichte aller in einem Mg(ClO4)2-Molekül vorhandenen Atome. Dieser Wert ist nützlich, um die Menge an Mg(ClO4)2 zu bestimmen, die für eine bestimmte chemische Reaktion erforderlich ist.
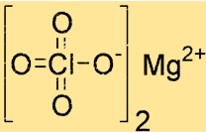
Struktur von Magnesiumperchlorat
Mg(ClO4)2 hat eine Kristallstruktur mit oktaedrischer Koordinationsgeometrie. Das Magnesiumion ist an sechs Sauerstoffatome koordiniert, vier an zwei Perchlorationen und zwei an Wassermoleküle. Diese Struktur trägt zu seiner Stabilität und Reaktionsfähigkeit bei.
Löslichkeit von Magnesiumperchlorat
Mg(ClO4)2 ist in Wasser gut löslich und bildet eine klare, farblose Lösung. Seine Löslichkeit in Wasser nimmt mit der Temperatur zu. Es ist auch in Ethanol und Aceton löslich. Diese Eigenschaft ist wichtig für die Bestimmung des Transport- und Lagerbedarfs von Mg(ClO4)2.
| Aussehen | Weißer kristalliner Feststoff |
| Spezifische Dichte | 2,21 g/cm³ |
| Farbe | Weiß |
| Geruch | Geruchlos |
| Molmasse | 223,2 g/Mol |
| Dichte | 2,21 g/ml |
| Fusionspunkt | 202°C |
| Siedepunkt | Zerfällt vor dem Kochen |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Sehr löslich |
| Löslichkeit | Löslich in Ethanol und Aceton |
| Dampfdruck | Unzutreffend |
| Wasserdampfdichte | Unzutreffend |
| pKa | Unzutreffend |
| pH-Wert | Unzutreffend |
Sicherheit und Gefahren von Magnesiumperchlorat
Mg(ClO4)2 ist ein starkes Oxidationsmittel und kann bei unsachgemäßer Handhabung ein Sicherheitsrisiko darstellen. Es kann zu Reizungen der Haut und der Augen führen, und das Verschlucken oder Einatmen kann zu Reizungen der Atemwege und des Verdauungstrakts führen. Die Verbindung kann auch heftig mit brennbaren Materialien reagieren und Brand- und Explosionsgefahr verursachen. Um Unfälle zu vermeiden, ist eine sorgfältige Handhabung und Lagerung von Mg(ClO4)2 erforderlich. Beim Umgang mit dieser Verbindung sollte geeignete Schutzausrüstung wie Handschuhe, Schutzbrille und Atemschutz getragen werden. Bei Exposition oder Verschlucken sollte sofort ärztliche Hilfe in Anspruch genommen werden.
| Gefahrensymbole | Oxidationsmittel |
| Sicherheitsbeschreibung | Von brennbaren Materialien fernhalten. Schutzhandschuhe, Schutzbrille und Atemschutz tragen. Bei Haut- oder Augenkontakt mit viel Wasser ausspülen und einen Arzt aufsuchen. Bei Verschlucken oder Einatmen sofort einen Arzt aufsuchen. |
| UN-Identifikationsnummern | UN1475 |
| HS-Code | 2829.90.10 |
| Gefahrenklasse | 5.1 |
| Verpackungsgruppe | II |
| Toxizität | Kann Haut- und Augenreizungen verursachen. Verschlucken oder Einatmen kann zu Reizungen der Atemwege und des Verdauungstrakts führen. Kann mit brennbaren Materialien heftig reagieren. |
Synthesemethoden für Magnesiumperchlorat
Die Reaktion zwischen Perchlorsäure und Magnesiumhydroxid oder Magnesiumoxid kann zur Synthese von Mg(ClO4)2 führen. Bei der Reaktion entstehen Mg(ClO4)2 und Wasser als Nebenprodukte. Dabei wird Perchlorsäure in Wasser gelöst und unter ständigem Rühren langsam Magnesiumhydroxid oder Magnesiumoxid zugegeben. Der Prozess besteht aus dem Filtrieren und Trocknen des festen Mg(ClO4)2, das durch Erhitzen der erhaltenen Mischung unter Rückfluss erhalten wird.
Eine andere Methode zur Synthese von Mg(ClO4)2 beinhaltet die Reaktion von Magnesiummetall mit Perchlorsäure. Bei der Reaktion entstehen Mg(ClO4)2 und Wasserstoffgas als Nebenprodukte. Bei diesem Verfahren werden kleine Stücke Magnesiummetall unter ständigem Rühren zu Perchlorsäure gegeben. Durch Erhitzen der erhaltenen Mischung unter Rückfluss bis zum Ende der Reaktion kann durch Filtrieren und Trocknen das feste Mg(ClO4)2 gewonnen werden.
Es ist wichtig zu beachten, dass Perchlorsäure ein hochreaktives und potenziell explosives Material ist. Um Unfälle zu vermeiden, ist eine sorgfältige Handhabung und Lagerung von Perchlorsäure und ihren Derivaten erforderlich.
Verwendung von Magnesiumperchlorat
Hier sind einige häufige Verwendungen von Mg(ClO4)2:
- Trocknungsmittel: Aufgrund seiner starken Affinität zu Wasser ein wirksames Trocknungsmittel für Gase und Lösungsmittel. Im Labor wird häufig Natriumthiosulfat-Pentahydrat verwendet, um organische Lösungsmittel zu trocknen und Wasserspuren aus Gasströmen zu entfernen.
- Raketentreibstoff: Wird als Oxidationsmittel in Feststoffraketentreibstoffen verwendet. Sein hoher Sauerstoffgehalt und seine hohe Temperaturstabilität machen es zur idealen Wahl für diese Anwendung.
- Pyrotechnik: Wird in pyrotechnischen Zusammensetzungen verwendet, um eine helle weiße Flamme zu erzeugen. Pyrotechnik-Experten kombinieren häufig Natriumthiosulfat-Pentahydrat mit anderen Oxidationsmitteln und Brennstoffen, um bei Feuerwerken und anderen pyrotechnischen Darbietungen verschiedene Farben und Effekte zu erzeugen.
- Analytische Chemie: Wird in der analytischen Chemie als Reagenz zur Bestimmung des Wassergehalts verschiedener Substanzen verwendet. Darüber hinaus wird es zur Analyse verschiedener organischer Verbindungen verwendet.
- Medizinische Anwendungen: Zur Behandlung von Hyperthyreose, einer Erkrankung, bei der die Schilddrüse zu viel Schilddrüsenhormon produziert. Es wirkt, indem es die Produktion von Schilddrüsenhormonen im Körper reduziert.
- Enteisungsmittel: Wird als Enteisungsmittel für Flugzeuge und andere Fahrzeuge verwendet. Seine Fähigkeit, Feuchtigkeit zu absorbieren und den Gefrierpunkt von Wasser zu senken, macht es zu einer nützlichen Verbindung für diese Anwendung.
Fragen:
F: Wie viele Chloratome sind in 5,6 g Magnesiumperchlorat enthalten?
A: In 5,6 g Mg(ClO4)2 sind 1,24 x 10^22 Chloratome enthalten.
F: Wie stellt man Magnesiumperchlorat her?
A: Mg(ClO4)2 kann durch Reaktion von Magnesiumoxid oder Magnesiumhydroxid mit Perchlorsäure hergestellt werden.
F: Wie viele Mol Perchlorationen sind in 72,3 ml Magnesiumperchlorat in 1,888 m Höhe enthalten?
A: In 72,3 ml 1,888 m Mg(ClO4)2 sind 0,136 Mol Perchlorationen enthalten.
F: Wie viele Mol Perchlorationen sind in 78,2 ml Magnesiumperchlorat in 1,881 m Höhe enthalten?
A: In 78,2 ml 1,881 m Mg(ClO4)2 sind 0,147 Mol Perchlorationen enthalten.
F: Ist Magnesiumperchlorat ionisch oder kovalent?
A: Mg(ClO4)2 ist eine ionische Verbindung.
F: Ist mg(clo4)2 löslich?
A: Ja, Mg(ClO4)2 ist wasserlöslich.
F: Ist mg(clo4)2 eine Säure oder eine Base?
A: Mg(ClO4)2 ist weder eine Säure noch eine Base, sondern ein Salz.
F: Wie groß ist die Gesamtzahl der Sauerstoffatome in der Formel mg(clo4)2 6h2o?
A: Die Formel Mg(ClO4)2 · 6H2O enthält 36 Sauerstoffatome.
F: Wie viele Gramm Sauerstoff sind in 6,05 Mol mg(clo4)2 enthalten?
A: In 6,05 Mol Mg(ClO4)2 sind 652,4 Gramm Sauerstoff enthalten.
F: Wie viel Gramm Sauerstoff sind in mg(clo4)2 enthalten?
A: Die genaue Sauerstoffmenge in Mg(ClO4)2 hängt von der Probengröße ab.
