1-Butanol (C4H9OH) ist ein farbloser Alkohol mit leicht süßlichem Geruch. Es wird als Lösungsmittel, in der organischen Synthese und als Kraftstoffquelle verwendet. Es kann auch in Kosmetik- und Körperpflegeprodukten verwendet werden.
| IUPAC-Name | Butan-1-ol |
| Molekularformel | C4H10O |
| CAS-Nummer | 71-36-3 |
| Synonyme | n-Butylalkohol, Butanol, Butylalkohol, 1-Butylalkohol, 1-Butanol, Butanolen, Butylenhydrat, Butylhydrat |
| InChI | InChI=1S/C4H10O/c1-2-3-4-5/h5H,2-4H2,1H3 |
Eigenschaften von 1-Butanol
Formel 1-Butanol
Die Summenformel von 1-Butanol lautet C4H10O. Das bedeutet, dass es vier Kohlenstoffatome, zehn Wasserstoffatome und ein Sauerstoffatom enthält. Es hat eine lineare Struktur, wobei die Hydroxylgruppe (-OH) an das erste Kohlenstoffatom gebunden ist.
1-Butanol Molmasse
Die Molmasse von C4H9OH beträgt 74,12 g/mol. Das bedeutet, dass ein Mol C4H9OH 74,12 Gramm wiegt. Die Molmasse ist eine wichtige Eigenschaft einer Substanz, da sie dabei hilft, die in einer bestimmten Probe vorhandene Substanzmenge zu bestimmen.
Siedepunkt von 1-Butanol
C4H9OH hat einen Siedepunkt von 117,7 °C (243,9 °F). Das bedeutet, dass es bei dieser Temperatur von flüssig in gasförmig übergeht. Der Siedepunkt von C4H9OH ist aufgrund des Vorhandenseins eines zusätzlichen Kohlenstoffatoms höher als der von Ethanol.
1-Butanol-Schmelzpunkt
Der Schmelzpunkt von C4H9OH beträgt -90,6 °C (-131,1 °F). Das bedeutet, dass es bei dieser Temperatur vom festen in den flüssigen Zustand übergeht. Der Schmelzpunkt von C4H9OH ist niedriger als der von Buttersäure, die ein ähnliches Molekulargewicht hat.
1-Butanol Dichte g/ml
Die Dichte von C4H9OH beträgt 0,81 g/ml. Das bedeutet, dass ein Milliliter C4H9OH 0,81 Gramm wiegt. Die Dichte von C4H9OH ist geringer als die von Wasser, das eine Dichte von 1 g/ml hat.
Molekulargewicht von 1-Butanol
Das Molekulargewicht von C4H9OH beträgt 74,12 g/mol. Es ist die Summe der Atomgewichte aller Atome in seiner Summenformel. Das Molekulargewicht ist eine wichtige Eigenschaft eines Stoffes, da es dabei hilft, seine physikalischen und chemischen Eigenschaften zu bestimmen.
Struktur von 1-Butanol
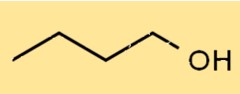
Die Struktur von C4H9OH ist ein geradkettiger Alkohol, bei dem die Hydroxylgruppe (-OH) an das erste Kohlenstoffatom gebunden ist. Es hat eine lineare Struktur mit vier Kohlenstoffatomen, zehn Wasserstoffatomen und einem Sauerstoffatom. Seine Struktur ermöglicht es ihm, Wasserstoffbrückenbindungen mit anderen Molekülen zu bilden.
Löslichkeit von 1-Butanol
C4H9OH ist in Wasser und organischen Lösungsmitteln löslich. Seine Löslichkeit in Wasser nimmt mit steigender Temperatur ab. Es ist auch in polaren Lösungsmitteln wie Ethanol und Methanol löslich. Die Löslichkeit von C4H9OH in organischen Lösungsmitteln wie Benzol und Ether ist höher als in Wasser. Dies macht es als Lösungsmittel in der organischen Synthese nützlich.
| Aussehen | Farblose Flüssigkeit |
| Spezifisches Gewicht | 0,810 g/ml bei 25 °C |
| Farbe | Farblos |
| Geruch | Leicht süß |
| Molmasse | 74,12 g/Mol |
| Dichte | 0,81 g/ml |
| Fusionspunkt | -90,6°C (-131,1°F) |
| Siedepunkt | 117,7 °C (243,9 °F) |
| Blitzpunkt | 35°C (95°F) |
| Löslichkeit in Wasser | 79 g/L bei 20°C |
| Löslichkeit | Löslich in Ethanol, Diethylether, Aceton, Benzol, Chloroform |
| Dampfdruck | 1,16 kPa bei 20°C |
| Wasserdampfdichte | 2,55 (bezogen auf Luft) |
| pKa | 16.06 |
| pH-Wert | Neutral (7) |
1-Sicherheit und Gefahren von Butanol
C4H9OH birgt mehrere Sicherheitsrisiken, weshalb ein sorgfältiger Umgang damit unerlässlich ist. Es handelt sich um eine brennbare Flüssigkeit, die sich bei Einwirkung von Hitze oder Funken leicht entzünden kann. Außerdem werden schädliche Dämpfe freigesetzt, die Reizungen und Schäden an Augen, Atemwegen und Haut verursachen können. Bei Einnahme kann es zu ernsthaften Gesundheitsproblemen wie Schwindel, Verwirrtheit und sogar Koma kommen. Beim Umgang mit C4H9OH ist daher unbedingt Schutzausrüstung wie Handschuhe, Schutzbrille und Atemschutzmaske zu tragen. Bei Kontakt mit der Haut oder den Augen sofort mit Wasser ausspülen und sofort einen Arzt aufsuchen. Um Unfälle zu verhindern und die Sicherheit zu gewährleisten, sind die ordnungsgemäße Lagerung, Handhabung und Entsorgung von C4H9OH erforderlich.
| Gefahrensymbole | F, Xi |
| Sicherheitsbeschreibung | Von Hitze/Funken/offener Flamme/heißen Oberflächen fernhalten. Schutzhandschuhe/Augenschutz/Gesichtsschutz tragen. BEI BERÜHRUNG MIT DER HAUT (oder dem Haar): Alle kontaminierten Kleidungsstücke sofort ausziehen. Haut mit Wasser abspülen/duschen. BEI KONTAKT MIT DEN AUGEN: Einige Minuten lang vorsichtig mit Wasser spülen. Entfernen Sie Kontaktlinsen, falls vorhanden und einfach möglich. Spülen Sie weiter. An einem kühlen, trockenen und gut belüfteten Ort fern von unverträglichen Substanzen lagern. |
| UN-Identifikationsnummern | UN 1120 |
| HS-Code | 2905.16.00 |
| Gefahrenklasse | 3 |
| Verpackungsgruppe | III |
| Toxizität | LD50 (oral, Ratte) 2,46 g/kg; LC50 (Inhalation, Ratte) 37.800 ppm/4h |
Methoden zur Synthese von 1-Butanol
C4H9OH kann durch verschiedene Methoden synthetisiert werden, einschließlich Butyraldehydreduktion, Oxoverarbeitung oder Fermentation.
Die Fermentation ist eine gängige Methode zur Herstellung von C4H9OH aus Biomasse. Im Fermentationsprozess sind Mikroorganismen wie Clostridium acetobutylicum dafür verantwortlich, durch die Fermentation von Zucker, Stärke oder Zellulose eine Mischung aus organischen Säuren und Alkoholen, einschließlich C4H9OH, zu produzieren.
Der Oxo-Prozess, auch Hydroformylierung genannt, beinhaltet die Reaktion von Propen mit Kohlenmonoxid und Wasserstoff in Gegenwart eines Katalysators wie Kobalt oder Rhodium. Bei der Hydrierung von Butyraldehyd entsteht C4H9OH. Bei der Hydrierung von Butyraldehyd entsteht die Verbindung C4H9OH.
Eine weitere Methode zur Synthese von C4H9OH besteht darin, Butyraldehyd mit Wasserstoff in Gegenwart eines Katalysators wie Palladium oder Nickel zu reduzieren. Bei dieser Reaktion entsteht C4H9OH mit Wasser als Nebenprodukt.
Das Fischer-Tropsch-Verfahren ist eine Methode zur Herstellung von C4H9OH aus fossilen Brennstoffen. Dabei wird ein Katalysator eingesetzt, um Kohlenmonoxid und Wasserstoff zur Reaktion zu bringen, was zur Bildung verschiedener Kohlenwasserstoffe, einschließlich C4H9OH, führt.
Verwendung von 1-Butanol
C4H9OH findet aufgrund seiner einzigartigen Eigenschaften vielfältige Einsatzmöglichkeiten in verschiedenen Branchen. Einige häufige Verwendungen von C4H9OH sind:
- Lösungsmittel: Wird als Lösungsmittel für verschiedene Substanzen verwendet, darunter Harze, Fette, Öle und Wachse.
- Zwischenprodukt: Wird als Zwischenprodukt bei der Herstellung anderer Chemikalien wie Butylacrylat und Butylacetat verwendet.
- Additiv: Wird als Additiv in Benzin- und Dieselkraftstoffen verwendet, um deren Oktanzahl zu erhöhen und Emissionen zu reduzieren.
- Extraktionsmittel: Wird als Extraktionsmittel bei der Herstellung von Antibiotika, Vitaminen und Hormonen verwendet.
- Kosmetik- und Körperpflegeprodukte: Wird bei der Herstellung verschiedener Kosmetik- und Körperpflegeprodukte verwendet, darunter Lotionen, Cremes und Parfüme.
- Aromen und Duftstoffe: Wird als Geschmacks- und Duftverstärker in der Lebensmittel- und Getränkeindustrie verwendet.
- Pharmazeutika: Wird bei der Herstellung verschiedener pharmazeutischer Produkte verwendet, darunter Beruhigungsmittel und Hypnotika.
- Pestizide: Wird als Bestandteil bei der Herstellung verschiedener Pestizide und Herbizide verwendet.
Fragen:
F: Ist Butanol polar?
A: Ja, Butanol ist aufgrund der Anwesenheit der Hydroxylgruppe (-OH) polar, die ihm ein Dipolmoment verleiht.
F: Ist 1-Butanol wasserlöslich?
A: Ja, C4H9OH ist teilweise in Wasser löslich, da es über eine Hydroxylgruppe verfügt, die es ihm ermöglicht, Wasserstoffbrückenbindungen mit Wassermolekülen zu bilden.
F: Hat 1-Butanol eine Wasserstoffbrücke?
A: Ja, C4H9OH verfügt aufgrund der Anwesenheit der Hydroxylgruppe (-OH) über eine Wasserstoffbindung, die Wasserstoffbrückenbindungen mit anderen C4H9OH-Molekülen oder mit Wassermolekülen bilden kann.
F: Wie viele ml 1-Butanol werden benötigt, um 725 ml einer 0,350 m wässrigen Lösung dieses gelösten Stoffes herzustellen?
A: Für die Berechnung ist die Molmasse von C4H9OH erforderlich, die 74,12 g/mol beträgt. Zur Herstellung einer 0,350 M Lösung von C4H9OH werden 26,12 g C4H9OH benötigt. Mit der Formel: Mol = Konzentration x Volumen können wir das benötigte Volumen an C4H9OH wie folgt berechnen: Volumen = Mol / Konzentration. Somit beträgt das Volumen an C4H9OH, das zur Herstellung von 725 ml einer 0,350 m Lösung benötigt wird, (26,12/0,350) = 74,6 ml.
F: Welcher Alkohol verhält sich am ähnlichsten wie Wasser? c2h5oh c4h9oh c10h21oh c7h15oh
A: Von den genannten Optionen verhält sich Ethanol (C2H5OH) aufgrund seiner geringen Molekülgröße und der Anwesenheit der Hydroxylgruppe (-OH), die es ihm ermöglicht, starke Wasserstoffbrückenbindungen mit Wassermolekülen zu bilden, am meisten wie Wasser.
F: Was sind die Produkte der ausgeglichenen Gleichung für die Verbrennung von c4h9oh?
A: Die ausgeglichene Gleichung für die Verbrennung von C4H9OH lautet: C4H9OH + 6O2 → 4CO2 + 5H2O. Die Reaktionsprodukte sind Kohlendioxid (CO2) und Wasser (H2O).
F: Wie groß ist die Molmasse von Butanol (c4h9oh)?
A: Die Molmasse von Butanol (C4H9OH) beträgt 74,12 g/mol.
F: Hat C4h9oh eine Wasserstoffbrücke?
A: Ja, C4H9OH verfügt aufgrund der Anwesenheit der Hydroxylgruppe (-OH) über eine Wasserstoffbindung, die es ihm ermöglicht, Wasserstoffbrückenbindungen mit anderen C4H9OH-Molekülen oder mit Wassermolekülen zu bilden.
F: Wie viele Gramm Butylalkohol (c4h9oh) sind in 2500 ml Lösung oder 2,22 m enthalten?
A: Um die Grammzahl Butylalkohol in der Lösung zu berechnen, müssen wir die Formel verwenden: Mol = Konzentration x Volumen. Die Konzentration der Lösung beträgt 2,22 Mol/L und das Volumen beträgt 2,5 L (2500 ml umgerechnet in L). Die Anzahl der Mol Butylalkohol in der Lösung beträgt also: 2,22 x 2,5 = 5,55 Mol. Um die Masse von Butylalkohol zu berechnen, multiplizieren Sie die Molzahl mit seiner Molmasse (74,12 g/mol): 5,55 x 74,12 = 411,4 g. In 2.500 ml Lösung sind also 411,4 Gramm Butylalkohol enthalten, also 2,22 M.
