2-Butanol ist eine farblose, brennbare Flüssigkeit mit süßem Geruch. Es wird häufig als Lösungsmittel und bei der Herstellung von Chemikalien wie Methylethylketon und Butylacetat verwendet.
| IUPAC-Name | 2-Butanol |
| Molekularformel | C4H10O |
| CAS-Nummer | 78-92-2 |
| Synonyme | Trockener Butylalkohol, 2-Butylalkohol, Butan-2-ol, Ethylmethylcarbinol |
| InChI | InChI=1S/C4H10O/c1-3-4(2)5/h4-5H,3H2,1-2H3 |
Eigenschaften von 2-Butanol
2-Butanol-Formel
Die chemische Formel für 2-Butanol lautet C4H10O, was darauf hinweist, dass es vier Kohlenstoffatome, zehn Wasserstoffatome und ein Sauerstoffatom enthält. Es ist ein Isomer von Butanol und hat die Strukturformel CH3CH(OH)CH2CH3. Die „2“ im Verbindungsnamen gibt die Position der Hydroxylgruppe an der Kohlenstoffkette an.
2-Butanol Molmasse
Die Molmasse von C4H10O beträgt 74,12 g/mol. Dieser Wert kann durch Addition der Atommassen aller Atome in der Verbindung ermittelt werden, die für Kohlenstoff 12,01 g/mol, für Wasserstoff 1,01 g/mol und für Sauerstoff 16,00 g/mol betragen. Die Molmasse ist eine wichtige Eigenschaft von C4H10O, da sie zur Berechnung der für chemische Reaktionen erforderlichen Verbindungsmenge verwendet wird.
Siedepunkt von 2-Butanol
Der Siedepunkt von C4H10O beträgt 99,5 °C (211,1 °F) bei Standarddruck (1 atm). Dies ist die Temperatur, bei der der flüssige Zustand der Verbindung in den gasförmigen Zustand übergeht. Der Siedepunkt von C4H10O ist aufgrund seiner Wasserstoffbrückenbindung und seines Molekulargewichts höher als der von Butan (−0,5 °C) und Buten (−6,3 °C).
2-Butanol-Schmelzpunkt
Der Schmelzpunkt von C4H10O beträgt −114,7 °C (−174,5 °F). Dies ist die Temperatur, bei der der feste Zustand der Verbindung in den flüssigen Zustand übergeht. Der Schmelzpunkt von C4H10O ist aufgrund seiner verzweigten Struktur und Wasserstoffbrückenbindungen niedriger als der von Butan (−138,4 °C) und Buten (−185,3 °C).
2-Butanol-Dichte g/ml
Die Dichte von C4H10O beträgt 0,809 g/ml bei 25 °C (77 °F). Dieser Wert gibt die Masse der Verbindung pro Volumeneinheit des Stoffes an. Die Dichte von C4H10O ist aufgrund seines Molekulargewichts und seiner intermolekularen Kräfte höher als die von Butan (0,588 g/ml) und Buten (0,587 g/ml).
Molekulargewicht von 2-Butanol
Das Molekulargewicht von C4H10O beträgt 74,12 g/mol. Es ist die Summe der Atomgewichte aller Atome in einem Molekül der Verbindung. Das Molekulargewicht wird zur Berechnung anderer Eigenschaften der Verbindung verwendet, wie z. B. Molmasse, Siedepunkt und Dichte.
Struktur von 2-Butanol
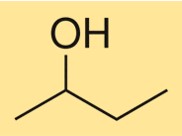
Die Struktur von C4H10O ist durch eine verzweigte Kohlenstoffkette gekennzeichnet, an deren zweites Kohlenstoffatom eine Hydroxylgruppe gebunden ist. Es handelt sich um einen primären Alkohol mit einem chiralen Zentrum, was bedeutet, dass er in zwei Stereoisomeren vorliegt, (R)-C4H10O und (S)-C4H10O. Aufgrund der tetraedrischen Anordnung von Kohlenstoff- und Sauerstoffatomen um die Hydroxylgruppe weist die Verbindung eine dreidimensionale Struktur auf.
Löslichkeit von 2-Butanol
C4H10O ist eine polare Verbindung und teilweise wasserlöslich. Die Löslichkeit von C4H10O in Wasser beträgt 80 g/L bei 25 °C (77 °F). Die Verbindung ist in organischen Lösungsmitteln wie Ethanol, Ether und Aceton besser löslich. Die Löslichkeit von C4H10O wird durch Faktoren wie Temperatur, Druck und die Art des Lösungsmittels beeinflusst.
| Aussehen | Klare Flüssigkeit |
| Spezifisches Gewicht | 0,810 g/ml bei 25 °C (77 °F) |
| Farbe | Farblos |
| Geruch | Charakteristisch |
| Molmasse | 74,12 g/Mol |
| Dichte | 0,809 g/ml bei 25 °C (77 °F) |
| Fusionspunkt | −114,7 °C (−174,5 °F) |
| Siedepunkt | 99,5 °C (211,1 °F) bei 1 atm Druck |
| Blitzpunkt | 39°C (102°F) geschlossener Becher |
| Löslichkeit in Wasser | 80 g/L bei 25 °C (77 °F) |
| Löslichkeit | Löslich in Ethanol, Ether und Aceton |
| Dampfdruck | 8,7 mmHg bei 25 °C (77 °F) |
| Wasserdampfdichte | 2,6 (Luft = 1) |
| pKa | 16 |
| pH-Wert | 7,0-8,5 |
Sicherheit und Gefahren von 2-Butanol
C4H10O gilt bei korrekter Handhabung als relativ sichere Chemikalie. Allerdings kann die Einwirkung hoher Konzentrationen zu Reizungen der Augen, der Haut und der Atemwege führen. Es kann auch Kopfschmerzen, Schwindel und Übelkeit verursachen. Die Einnahme von C4H10O kann zu Magen-Darm-Reizungen und möglicherweise zu einer Depression des Zentralnervensystems führen. Darüber hinaus ist C4H10O brennbar und kann eine Brandgefahr darstellen. Es sollte an einem kühlen, trockenen und gut belüfteten Ort fern von Zündquellen gelagert werden. Beim Umgang mit dieser Chemikalie sollte geeignete persönliche Schutzausrüstung wie Handschuhe und Schutzbrille getragen werden. Verschüttungen sollten umgehend mit geeigneten Verfahren beseitigt werden.
| Gefahrensymbole | F, Xi |
| Sicherheitsbeschreibung | Von Hitze/Funken/offener Flamme/heißen Oberflächen fernhalten. Schutzhandschuhe/Schutzkleidung/Augenschutz/Gesichtsschutz tragen. BEI BERÜHRUNG MIT DER HAUT (oder dem Haar): Alle kontaminierten Kleidungsstücke sofort ausziehen. Haut mit Wasser abspülen/duschen. BEI EINATMEN: Das Opfer an die frische Luft bringen und in einer Position ruhigstellen, die das Atmen erleichtert. BEI VERSCHLUCKEN: Mund ausspülen. KEIN Erbrechen herbeiführen. Bei Unwohlsein GIFTINFORMATIONSZENTRUM oder Arzt anrufen. |
| UN-Identifikationsnummern | UN1120 |
| HS-Code | 2905.13.00 |
| Gefahrenklasse | 3 – Brennbare Flüssigkeiten |
| Verpackungsgruppe | III |
| Toxizität | LD50 (oral, Ratte): 4,6 g/kg; LC50 (Inhalation, Ratte): 2.100 ppm/4 h |
Methoden zur Synthese von 2-Butanol
Zur Synthese von C4H10O können verschiedene Methoden verwendet werden.
Eine Methode beinhaltet die Reduktion von Aceton mit Natriumborhydrid in Gegenwart eines Nickel- oder Palladiumkatalysators. Bei der Reaktion entsteht ein Gemisch aus C4H10O und seinem Isomer Isobutanol, das durch fraktionierte Destillation getrennt werden kann.
Eine andere Methode beinhaltet die Hydratisierung von 1-Buten unter Verwendung von Schwefelsäure als Katalysator. Bei der Reaktion entsteht ein Gemisch aus C4H10O und seinen Isomeren, das gewünschte C4H10O kann jedoch durch fraktionierte Destillation abgetrennt werden.
Beim Reppe-Chemieverfahren wird ein Palladium- oder Nickelkatalysator verwendet, um Acetylen mit Formaldehyd und Wasser zu reagieren, was zur Bildung von Vinylalkohol führt. Diese Reaktion führt weiter zur Synthese von C4H10O. Der Vinylalkohol wird dann hydriert, um C4H10O zu bilden.
Eine weitere Methode zur Synthese von C4H10O beinhaltet die Hydrierung von Crotonaldehyd in Gegenwart eines Nickelkatalysators. Bei der Reaktion entsteht ein Gemisch aus C4H10O und seinem Isomer, das gewünschte C4H10O kann jedoch durch fraktionierte Destillation isoliert werden.
Verwendung von 2-Butanol
C4H10O hat eine Vielzahl von Anwendungen in verschiedenen Branchen. Einige seiner Verwendungsmöglichkeiten sind:
- Lösungsmittel: Wird als Lösungsmittel bei der Herstellung von Harzen, Lacken und Beschichtungen verwendet. Wird auch als Lösungsmittel für Celluloseether und -ester verwendet.
- Kraftstoff: Wird aufgrund seiner geringen Toxizität und seines hohen Energiegehalts als Biokraftstoffzusatz verwendet. Es hat sich gezeigt, dass es eine höhere Verbrennungseffizienz als Ethanol hat und wird als potenzielle Alternative zu Benzin untersucht.
- Chemisches Zwischenprodukt: Wird als Rohstoff für die Herstellung anderer Chemikalien wie Methylethylketon, Methylisobutylketon und Diisobutylen verwendet.
- Parfüm und Duft: Wird als Duft- und Aromastoff bei der Herstellung von Parfüms, Seifen und anderen Körperpflegeprodukten verwendet.
- Laborreagenz: Wird als Lösungsmittel und Reagenz in Experimenten der organischen Chemie verwendet.
- Reinigungsmittel: Wird als Reinigungsmittel in Industrie- und Haushaltsreinigungsprodukten verwendet.
- Druckfarbe: Wird auch als Lösungsmittel bei der Herstellung von Druckfarben verwendet.
Fragen:
F: Welche Carbonylverbindung und welches Grignard-Reagenz könnten zur Herstellung von 2-Butanol verwendet werden?
A: Die Carbonylverbindung, die zur Herstellung von C4H10O verwendet werden könnte, ist Butanal (auch bekannt als n-Butyraldehyd), und das Grignard-Reagenz, das verwendet werden könnte, ist Ethylmagnesiumbromid. Bei der Reaktion zwischen Butanal und Ethylmagnesiumbromid entsteht als Endprodukt C4H10O.
F: Ist 2-Butanol polar?
A: Ja, C4H10O ist polar. Es enthält eine Hydroxylgruppe (-OH), eine polare funktionelle Gruppe, die das Molekül polar macht.
F: Ist 2-Butanol wasserlöslich?
A: Ja, C4H10O ist teilweise wasserlöslich. Die polare Hydroxylgruppe von C4H10O ermöglicht die Bildung von Wasserstoffbrückenbindungen mit Wassermolekülen, wodurch es in Wasser einigermaßen löslich wird.
F: Hat 2-Butanol eine Wasserstoffbrücke?
A: Ja, C4H10O kann Wasserstoffbrückenbindungen bilden. Die Hydroxylgruppe (-OH) in C4H10O kann Wasserstoffbrückenbindungen mit anderen polaren Molekülen bilden, die Wasserstoffbrückenbindungsstellen enthalten, wie beispielsweise Wasser.
