Kaliumperchlorat (KClO4) ist eine Verbindung, die Kalium, Chlor und Sauerstoff enthält. Aufgrund seiner oxidierenden Eigenschaften wird es häufig in der Pyrotechnik und in Sprengstoffen verwendet.
| Name der IUPAC | Kaliumperchlorat |
| Molekularformel | KClO4 |
| CAS-Nummer | 7778-74-7 |
| Synonyme | Percal K, Kaliperchlorat, Kaliumchlorat (VII), UN 1489 |
| InChI | InChI=1S/ClHO4.K/c2-1(3,4)5;/h(H,2,3,4,5);/q;+1/p-1 |
Eigenschaften von Kaliumperchlorat
Kaliumperchlorat-Formel
Kaliumperchlorat hat die chemische Formel KClO4, die angibt, dass es ein Kaliumatom, ein Chloratom und vier Sauerstoffatome enthält. Die Verbindung ist ein anorganisches Salz, das in Wasser gut löslich ist und daher in vielen Anwendungen ein nützliches Oxidationsmittel ist.
Molmasse von Kaliumperchlorat
Die Molmasse von KClO4 wird durch Addition der Atommassen der Bestandteile der Verbindung berechnet. Die Atommassen von Kalium, Chlor und Sauerstoff betragen jeweils 39,10 g/mol, 35,45 g/mol und 16,00 g/mol. Die Molmasse von KClO4 beträgt also 138,55 g/mol.
Siedepunkt von Kaliumperchlorat
KClO4 hat keinen definierten Siedepunkt, da es sich vor Erreichen des Siedepunkts zersetzt. Beim Erhitzen auf hohe Temperaturen zerfällt KClO4 in Kaliumchlorid und Sauerstoffgas. Es wurde jedoch beobachtet, dass die Verbindung bei Temperaturen um 400 bis 500 °C sublimieren kann.
Kaliumperchlorat Schmelzpunkt
Der Schmelzpunkt von KClO4 liegt bei etwa 610 °C. Bei dieser Temperatur geht die feste Verbindung in den flüssigen Zustand über. Der hohe Schmelzpunkt von KClO4 macht es für den Einsatz in verschiedenen industriellen Anwendungen geeignet.
Dichte von Kaliumperchlorat g/ml
Die Dichte von KClO4 beträgt bei Raumtemperatur etwa 2,52 g/cm³. Dies weist darauf hin, dass die Verbindung dichter ist als Wasser, das eine Dichte von 1 g/cm³ hat. Die hohe Dichte von KClO4 macht es zu einem wirksamen Oxidationsmittel in der Pyrotechnik.
Molekulargewicht von Kaliumperchlorat
Das Molekulargewicht von KClO4 beträgt 138,55 g/mol. Dieser Wert wird durch Addition der Atommassen der Bestandteile der Verbindung ermittelt. Das Molekulargewicht von KClO4 ist hilfreich bei der Bestimmung der Masse der Verbindung, die für eine bestimmte Reaktion oder einen bestimmten Prozess benötigt wird.
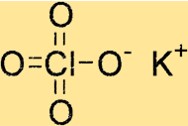
Struktur von Kaliumperchlorat
KClO4 hat eine tetragonale Kristallstruktur, das heißt, es weist eine vierzählige Symmetrie um seine c-Achse auf. Das Kristallgitter der Verbindung besteht aus Kaliumionen, Chlorionen und Sauerstoffionen, die durch Ionenbindungen zusammengehalten werden.
Löslichkeit von Kaliumperchlorat
KClO4 ist in Wasser gut löslich, mit einer Löslichkeit von etwa 4,5 g/ml bei Raumtemperatur. Die Verbindung ist auch in anderen polaren Lösungsmitteln wie Ethanol und Aceton löslich. Allerdings ist es in unpolaren Lösungsmitteln wie Benzol und Chloroform unlöslich. Die Löslichkeit von KClO4 ist ein wichtiger Faktor bei seiner Verwendung als Oxidationsmittel in verschiedenen industriellen Anwendungen.
| Aussehen | Weißer kristalliner Feststoff |
| Spezifische Dichte | 2,52 |
| Farbe | Weiß |
| Geruch | Geruchlos |
| Molmasse | 138,55 g/Mol |
| Dichte | 2,52 g/cm³ |
| Fusionspunkt | 610°C |
| Siedepunkt | Zersetzt sich vor dem Siedepunkt |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | 4,5 g/ml bei 25 °C |
| Löslichkeit | Löslich in Ethanol und Aceton, unlöslich in Benzol und Chloroform |
| Dampfdruck | Unzutreffend |
| Wasserdampfdichte | Unzutreffend |
| pKa | Unzutreffend |
| pH-Wert | Neutral |
Sicherheit und Gefahren von Kaliumperchlorat
KClO4 kann bei unsachgemäßer Handhabung ein Sicherheitsrisiko darstellen. Die Verbindung ist ein starkes Oxidationsmittel und kann mit brennbaren Materialien reagieren und Brände oder Explosionen verursachen. Das Einatmen von KClO4-Staub oder -Dampf kann ebenfalls zu Reizungen der Atemwege führen. Eine längere Einwirkung der Verbindung kann zu Hautreizungen oder Dermatitis führen. Beim Umgang mit KClO4 ist es wichtig, geeignete persönliche Schutzausrüstung wie Handschuhe, Schutzbrille und Atemschutzmasken zu verwenden. Die Verbindung sollte außerdem an einem kühlen, trockenen Ort, entfernt von inkompatiblen Materialien sowie Wärme- und Zündquellen, gelagert werden.
| Gefahrensymbole | Oxidationsmittel |
| Sicherheitsbeschreibung | Von brennbaren Materialien fernhalten. Tragen Sie geeignete persönliche Schutzausrüstung. Vermeiden Sie das Einatmen von Staub oder Dämpfen. |
| UN-Identifikationsnummern | UN1489 |
| HS-Code | 2829.90.90 |
| Gefahrenklasse | 5.1 – Oxidierende Stoffe |
| Verpackungsgruppe | II |
| Toxizität | Kann bei längerer Exposition Hautreizungen oder Dermatitis verursachen. Das Verschlucken oder Einatmen der Verbindung kann zu Reizungen der Atemwege führen. |
Methoden zur Synthese von Kaliumperchlorat
KClO4 kann auf verschiedene Weise synthetisiert werden.
Eine übliche Methode ist die Reaktion von Kaliumchlorat mit Bariumperchlorat. Bei der Reaktion entstehen KClO4 und Bariumchlorid als Nebenprodukt, die filtriert werden können.
Eine andere Methode beinhaltet die Reaktion von Kaliumchlorat mit Salzsäure und Natriumchlorid. Bei der Reaktion entstehen KClO4 und Natriumchlorat, die durch Kristallisation getrennt werden können.
Durch die Reaktion zwischen Kaliumhydroxid und Ammoniumperchlorat kann auch KClO4 synthetisiert werden. Bei der Reaktion entstehen KClO4 und Ammoniumhydroxid, die durch Filtration abgetrennt werden können.
Eine andere Methode beinhaltet die Reaktion von Kaliumchlorid mit Natriumperchlorat in Gegenwart eines Katalysators. Bei der Reaktion entstehen KClO4 und Natriumchlorid, die durch Kristallisation getrennt werden können.
Verwendung von Kaliumperchlorat
KClO4 wird in unterschiedlichen Branchen vielfältig eingesetzt. Einige seiner häufigsten Verwendungszwecke sind:
- Pyrotechnik: Ein beliebtes Oxidationsmittel in der Pyrotechnikindustrie. Wird bei der Herstellung von Feuerwerkskörpern, Leuchtraketen und anderen Arten von Sprengstoffen verwendet.
- Raketenpropeller: Wird als Oxidationsmittel bei der Herstellung von Raketentreibstoffen verwendet. Wird häufig in Feststoffraketen-Boostern und Space-Shuttle-Starts verwendet.
- Airbag-Initiatoren: Wird als Initiator bei der Herstellung von Airbags verwendet. Um einen Airbag auszulösen, wird eine elektrische Ladung durch einen mit KClO4 beschichteten Draht gesendet. Dadurch kommt es zu einer Reaktion, bei der Stickstoffgas entsteht, das den Airbag aufbläst.
- Streichhölzer: Wird zur Herstellung von Sicherheitsstreichhölzern verwendet. Um eine brennbare Verbindung herzustellen, die sich beim Auftreffen auf eine raue Oberfläche entzündet, wird sie mit Antimonsulfid und Schwefel vermischt.
- Galvanisieren: Wird in der Galvanikindustrie als Bestandteil von Elektrolyten zum Galvanisieren von Metallen verwendet.
- Medizin: Wird zur Behandlung von Schilddrüsenerkrankungen wie Hyperthyreose eingesetzt. Aufgrund von Sicherheitsbedenken ist seine Verwendung in der Medizin jedoch zurückgegangen.
- Analytische Chemie: Wird auch als Reagenz in der analytischen Chemie zur Bestimmung bestimmter Substanzen verwendet.
Fragen:
F: Welche Arten von Bindungen sind in einem Kaliumperchloratmolekül enthalten?
A: KClO4 enthält sowohl ionische als auch kovalente Bindungen. Das K+-Ion und das ClO4–Ion werden durch ionische Bindungen zusammengehalten, während das Perchloration selbst sowohl kovalente als auch ionische Bindungen enthält.
F: Wie lautet die Formel für Kaliumperchlorat?
A: KClO4.
F: Ist Kaliumperchlorat wässrig?
A: KClO4 kann sich in Wasser lösen und es unter bestimmten Bedingungen wässrig machen.
F: Wofür wird Kaliumperchlorat verwendet?
A: KClO4 hat verschiedene Anwendungen, unter anderem in Feuerwerkskörpern, Raketentriebwerken und Airbag-Gasgeneratoren. Es wird auch in der analytischen Chemie als Reagenz und Oxidationsmittel verwendet.
F: Wie stellt man Blitzpulver ohne Kaliumperchlorat her?
A: Flash-Pulver kann ohne KClO4 unter Verwendung alternativer Oxidationsmittel wie Ammoniumperchlorat, Natriumperchlorat oder Bariumperoxid hergestellt werden.
F: Welchen Oxidationszustand hat ein einzelnes Chloratom in KClO4?
A: Die Oxidationsstufe des einzelnen Chloratoms in KClO4 beträgt +7.
F: Ist KClO4 wasserlöslich?
A: Ja, KClO4 ist wasserlöslich.
F: Ist KClO4 eine Säure oder eine Base?
A: KClO4 ist weder eine Säure noch eine Base. Es ist ein Salz, das aus einem Metall (Kalium) und einem mehratomigen Ion (Perchlorat) besteht.
