Natriumperchlorat ist eine chemische Verbindung mit der Formel NaClO4. Es handelt sich um einen weißen kristallinen Feststoff, der in Wasser gut löslich ist und häufig als Oxidationsmittel in verschiedenen industriellen Prozessen verwendet wird.
| IUPAC-Name | Natriumperchlorat |
| Molekularformel | NaClO4 |
| CAS-Nummer | 7601-89-0 |
| Synonyme | Perchlorsäure, Natriumsalz; Natriumperchlorat (Französisch); Natriumperchlorat (deutsch); Perclorato di sodio (Italienisch); Perclorato sodico (Spanisch); UN 1502 |
| InChI | InChI=1S/ClHO4.Na/c2-1(3,4)5;/h(H,2,3,4,5);/q;+1/p-1 |
Eigenschaften von Natriumperchlorat
Natriumperchlorat-Formel
Die chemische Formel für Natriumperchlorat lautet NaClO4. Das bedeutet, dass die Verbindung aus einem Natriumatom, einem Chloratom und vier Sauerstoffatomen besteht. Natriumperchlorat ist ein starkes Oxidationsmittel, das häufig in verschiedenen industriellen Prozessen verwendet wird.
Molmasse von Natriumperchlorat
Die Molmasse von NaClO4 beträgt 122,44 g/mol. Das bedeutet, dass ein Mol NaClO4 122,44 Gramm der Verbindung enthält. Die Molmasse einer Verbindung ist wichtig für die Bestimmung der Stoffmenge, die für eine chemische Reaktion benötigt wird.
Siedepunkt von Natriumperchlorat
Der Siedepunkt von NaClO4 liegt bei 545°C (1013 hPa). Dies ist die Temperatur, bei der die Verbindung von flüssig in gasförmig übergeht. NaClO4 hat aufgrund der starken elektrostatischen Kräfte zwischen Natrium- und Perchlorationen einen hohen Siedepunkt.
Natriumperchlorat Schmelzpunkt
Der Schmelzpunkt von NaClO4 beträgt 482°C. Dies ist die Temperatur, bei der die Verbindung vom festen in den flüssigen Zustand übergeht. NaClO4 hat aufgrund der starken elektrostatischen Kräfte zwischen Natrium- und Perchlorationen einen hohen Schmelzpunkt.
Dichte von Natriumperchlorat g/ml
Die Dichte von NaClO4 beträgt 2,52 g/ml. Das bedeutet, dass ein Milliliter NaClO4 2,52 Gramm wiegt. Die Dichte eines Stoffes ist wichtig für die Bestimmung seiner physikalischen Eigenschaften wie Auftrieb und Viskosität.
Molekulargewicht von Natriumperchlorat
Das Molekulargewicht von NaClO4 beträgt 122,44 g/mol. Dies ist die Summe der Atomgewichte der Natrium-, Chlor- und Sauerstoffatome in der Verbindung. Das Molekulargewicht einer Verbindung ist wichtig für die Bestimmung ihrer physikalischen und chemischen Eigenschaften.
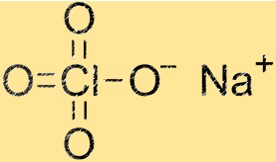
Struktur von Natriumperchlorat
Die Struktur von NaClO4 ist ein Kristallgitter bestehend aus Na+-Kationen und ClO4–Anionen. Natriumkationen sind von vier Sauerstoffatomen umgeben, während ClO4-Anionen aus einem Chloratom und vier Sauerstoffatomen bestehen. Die Kristallgitterstruktur verleiht NaClO4 seine charakteristischen physikalischen und chemischen Eigenschaften.
Löslichkeit von Natriumperchlorat
NaClO4 ist in Wasser gut löslich, mit einer Löslichkeit von 209 g/100 ml bei 20 °C. Das bedeutet, dass sich eine große Menge NaClO4 in einer kleinen Menge Wasser lösen kann. Die hohe Löslichkeit von NaClO4 macht es in verschiedenen industriellen Prozessen nützlich, beispielsweise bei der Herstellung von Ammoniumperchlorat für Raketentreibstoff.
| Aussehen | Weißer kristalliner Feststoff |
| Spezifisches Gewicht | 2,52 g/ml |
| Farbe | Weiß |
| Geruch | Geruchlos |
| Molmasse | 122,44 g/Mol |
| Dichte | 2,52 g/ml |
| Fusionspunkt | 482°C |
| Siedepunkt | 545°C (1013hPa) |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | 209 g/100 ml bei 20 °C |
| Löslichkeit | Löslich in Wasser und Ethanol |
| Dampfdruck | Nicht verfügbar |
| Wasserdampfdichte | Nicht verfügbar |
| pKa | Nicht verfügbar |
| pH-Wert | Nicht verfügbar |
Sicherheit und Gefahren von Natriumperchlorat
NaClO4 ist eine gefährliche Verbindung, die mit Vorsicht gehandhabt werden muss. Es ist ein starkes Oxidationsmittel, das heftig mit organischen Materialien, Reduktionsmitteln und anderen Chemikalien reagieren kann. Der Kontakt mit NaClO4-Staub oder -Dampf kann zu Reizungen der Augen, der Haut und der Atemwege führen. Die Einnahme von NaClO4 kann zu Magen-Darm-Reizungen, Übelkeit und Erbrechen führen. NaClO4 ist außerdem schädlich für Wasserlebewesen und muss ordnungsgemäß entsorgt werden. Beim Umgang mit NaClO4 sollte persönliche Schutzausrüstung wie Handschuhe, Schutzbrille und Atemschutzmaske getragen werden, um eine Exposition zu vermeiden. Auch die richtige Belüftung und Lagerung ist wichtig, um das Unfallrisiko zu minimieren.
| Gefahrensymbole | O, Xn |
| Sicherheitsbeschreibung | Staub/Rauch/Gas/Nebel/Dampf/Aerosol nicht einatmen. Schutzhandschuhe/Schutzkleidung/Augenschutz/Gesichtsschutz tragen. BEI EINATMEN: Das Opfer an die frische Luft bringen und in einer Position ruhigstellen, die das Atmen erleichtert. BEI VERSCHLUCKEN: Mund ausspülen. KEIN Erbrechen herbeiführen. Bei Unwohlsein GIFTINFORMATIONSZENTRUM oder Arzt anrufen. |
| UN-Identifikationsnummern | UN1502 |
| HS-Code | 2829.90.90 |
| Gefahrenklasse | 5.1 |
| Verpackungsgruppe | II |
| Toxizität | Giftig beim Verschlucken, gesundheitsschädlich beim Einatmen oder bei Hautkontakt. Kann Reizungen oder Korrosion verursachen. |
Methoden zur Synthese von Natriumperchlorat
Verschiedene Methoden können NaClO4 synthetisieren.
Eine übliche Methode beinhaltet die Reaktion von Natriumchlorat mit Salzsäure , was zur Bildung von NaClO4 und Natriumchlorid führt.
Eine andere Methode beinhaltet die Elektrolyse einer Natriumchloridlösung in Gegenwart eines Perchloratsalzes. Es erfolgt die Umwandlung von Natriumchlorid in Natriumchlorat, gefolgt von der Zugabe von Salzsäure, die es in NaClO4 umwandelt.
Ein anderer Ansatz besteht darin, Natriumchlorat mit Natriumchlorid in Gegenwart von Schwefelsäure umzusetzen. Bei dieser Methode entsteht ein Gemisch aus NaClO4 und Natriumsulfat, das durch fraktionierte Kristallisation getrennt werden kann.
Eine andere Methode beinhaltet die Reaktion von Natriumchlorat mit Ammoniumperchlorat, wodurch NaClO4 und Ammoniumchlorid entstehen. Bei der Herstellung von NaClO4, das üblicherweise als Oxidationsmittel in Feststoffraketentreibstoffen verwendet wird, kommt diese Methode zum Einsatz.
Bei der Reaktion von Natriumhypochlorit mit Natriumchlorat in Gegenwart von Salzsäure entsteht ebenfalls NaClO4. Bei dieser Methode entstehen als Hauptprodukte NaClO4 und Natriumchlorid.
Verwendungsmöglichkeiten von Natriumperchlorat
NaClO4 wird in unterschiedlichen Branchen vielfältig eingesetzt. Hier sind einige häufige Anwendungen von NaClO4:
- Raketentreibstoffe: Aufgrund ihres hohen Sauerstoffgehalts und ihrer hohen Stabilität werden sie häufig als Oxidationsmittel in Feststoffraketentreibstoffen verwendet.
- Pyrotechnik: Wird als Oxidationsmittel in pyrotechnischen Zusammensetzungen wie Leuchtraketen, Feuerwerkskörpern und Leuchtraketen verwendet.
- Analytische Chemie: Wird als Quelle für Perchlorationen in der analytischen Chemie zur Bestimmung von Ionen in verschiedenen Proben verwendet.
- Galvanisieren: Wird als Komponente in Galvanisierungslösungen verwendet, um die Leitfähigkeit und Stabilität des Galvanisierungsbades zu verbessern.
- Batterien: Wird aufgrund seiner hohen Löslichkeit und Fähigkeit, die elektrochemischen Eigenschaften der Batterie zu verbessern, als Elektrolyt in Lithium-Ionen-Batterien verwendet.
- Medizinische Anwendungen: Wird bei der Behandlung von Schilddrüsenerkrankungen als kompetitiver Inhibitor des Jodtransports verwendet. Wird auch bei der Herstellung von Kontrastmitteln für die medizinische Bildgebung verwendet.
- Wasseraufbereitung: Wird bei der Wasseraufbereitung als Desinfektionsmittel und zur Entfernung bestimmter Verunreinigungen aus dem Wasser verwendet.
Fragen:
F: Wie lautet die Formel für Natriumperchlorat?
A: NaClO4.
F: Ist Natriumperchlorat wasserlöslich?
A: Ja, NaClO4 ist in Wasser gut löslich.
F: Ist Natriumperchlorat eine Säure oder eine Base?
A: NaClO4 ist weder eine Säure noch eine Base. Es ist Salz.
F: Wie reagieren Ammoniumperchlorat und Natriumbromid?
A: Die Reaktion ist: NH4ClO4 + NaBr → NaClO4 + NH4Br.
F: Wie viele Natriumionen enthält Natriumperchlorat?
A: NaClO4 enthält ein Natriumion.
F: Ist NaClO4 eine Säure oder eine Base?
A: NaClO4 ist weder eine Säure noch eine Base. Es ist ein Salz.
F: Welche gelösten Spezies sind in einer NaClO4-Lösung vorhanden?
A: In einer NaClO4-Lösung sind die gelösten Spezies Na+- und ClO4–Ionen.
F: Wie viele Mol Sauerstoff sind in 3,30 Mol NaClO4 enthalten?
A: In 3,30 Mol NaClO4 sind 13,2 Mol Sauerstoff enthalten.
F: Ist NaClO4 wasserlöslich?
A: Ja, NaClO4 ist in Wasser gut löslich.
F: Wie viele Mol Sauerstoff sind in 1,10 Mol NaClO4 enthalten?
A: In 1,10 Mol NaClO4 sind 4,4 Mol Sauerstoff enthalten.
