Magnesiumchlorat (Mg(ClO3)2) ist eine Verbindung bestehend aus Mg2+- und ClO3–Ionen. Es ist ein wasserlösliches und hochreaktives weißes kristallines Pulver. Es kann als Oxidationsmittel bei der Herstellung von Feuerwerkskörpern und als Desinfektionsmittel bei der Wasseraufbereitung eingesetzt werden.
| IUPAC-Name | Magnesiumchlorat |
| Molekularformel | Mg(ClO3)2 |
| CAS-Nummer | 10326-21-3 |
| Synonyme | Magnesiumdiperchlorat, Magnesium(II)-chlorat, Magnesiumchlorat-Hexahydrat |
| InChI | InChI=1S/2ClHO3.Mg/c2 2-1(3)4;/h2 (H,2,3,4);/q;;+2/p-2 |
Eigenschaften von Magnesiumchlorat
Magnesiumchlorat-Formel
Magnesiumchlorat ist eine chemische Verbindung mit der Formel Mg(ClO3)2. Die Verbindung besteht aus einem Magnesiumion (Mg2+) und zwei ClO3-Ionen. Die chemische Formel besagt, dass ein Molekül Magnesiumchlorat zwei Chloridionen und sechs Sauerstoffatome enthält.
Molmasse von Magnesiumchlorat
Die Molmasse von Mg(ClO3)2 beträgt 191,2 g/mol. Dieser Wert wird durch Addition der Atomgewichte der in einem Mg(ClO3)2-Molekül vorhandenen Elemente berechnet. Magnesium hat eine Molmasse von 24,31 g/mol, während Chlor und Sauerstoff Molmassen von 35,45 g/mol bzw. 16,00 g/mol haben. Indem wir die Molmasse jedes Elements mit der Anzahl der Atome dieses Elements im Molekül multiplizieren und diese addieren, erhalten wir die Molmasse der Verbindung.
Siedepunkt von Magnesiumchlorat
Mg(ClO3)2 zersetzt sich, bevor es seinen Siedepunkt erreicht. Beim Erhitzen zerfällt Mg(ClO3)2 in Magnesiumchlorid, Sauerstoffgas und Chlorgas. Daher hat Mg(ClO3)2 keinen Siedepunkt.
Schmelzpunkt von Magnesiumchlorat
Der Schmelzpunkt von Mg(ClO3)2 beträgt 105°C. Bei dieser Temperatur geht die feste Verbindung in flüssige Form über. Der Schmelzpunkt von Mg(ClO3)2 kann je nach Reinheit der Verbindung und den Bedingungen, unter denen sie gemessen wird, variieren.
Dichte von Magnesiumchlorat g/ml
Die Dichte von Mg(ClO3)2 beträgt 2,21 g/ml. Das bedeutet, dass ein Milliliter Mg(ClO3)2 eine Masse von 2,21 Gramm hat. Die Dichte von Mg(ClO3)2 kann verwendet werden, um das Volumen einer gegebenen Masse der Verbindung oder die Masse eines gegebenen Volumens der Verbindung zu berechnen.
Molekulargewicht von Magnesiumchlorat
Das Molekulargewicht von Mg(ClO3)2 beträgt 191,2 g/mol. Dieser Wert wird durch Addition der Atomgewichte der in einem Mg(ClO3)2-Molekül vorhandenen Elemente berechnet.
Struktur von Magnesiumchlorat
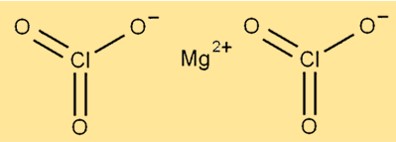
Die Struktur von Mg(ClO3)2 besteht aus Magnesiumionen, die von sechs Sauerstoffatomen und zwei Chloratomen umgeben sind. Das Magnesiumion befindet sich im Zentrum des Moleküls, während die Sauerstoff- und Chloratome um es herum angeordnet sind. Die Verbindung hat eine kristalline Struktur und eine weiße Farbe.
Löslichkeit von Magnesiumchlorat
Mg(ClO3)2 ist in Wasser, Ethanol und Aceton löslich. Die Löslichkeit von Mg(ClO3)2 in Wasser steigt mit der Temperatur. Bei Raumtemperatur können sich etwa 31 Gramm Mg(ClO3)2 in 100 ml Wasser lösen. Die Löslichkeit von Mg(ClO3)2 in anderen Lösungsmitteln hängt von der Polarität des Lösungsmittels ab.
| Aussehen | weißes kristallines Pulver |
| Spezifisches Gewicht | 2,21 g/cm3 |
| Farbe | Weiß |
| Geruch | Geruchlos |
| Molmasse | 191,2 g/Mol |
| Dichte | 2,21 g/ml |
| Fusionspunkt | 105°C |
| Siedepunkt | Zerfällt vor dem Kochen |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Löslich |
| Löslichkeit | Löslich in Wasser, Ethanol und Aceton |
| Dampfdruck | Unzutreffend |
| Wasserdampfdichte | Unzutreffend |
| pKa | Unzutreffend |
| pH-Wert | Unzutreffend |
Sicherheit und Gefahren von Magnesiumchlorat
Mg(ClO3)2 ist ein starkes Oxidationsmittel und kann heftig mit brennbaren Materialien reagieren und Brände oder Explosionen verursachen. Außerdem kann es bei Kontakt oder Einatmen zu Reizungen der Haut, der Augen und der Atemwege kommen. Daher sollte beim Umgang mit Mg(ClO3)2 geeignete persönliche Schutzausrüstung wie Handschuhe und Schutzbrille getragen werden. Die Verbindung sollte außerdem fern von brennbaren Materialien und Wärme- oder Zündquellen gelagert werden. Darüber hinaus muss für ausreichende Belüftung gesorgt werden, um das Einatmen von Staub oder Dämpfen aus der Verbindung zu verhindern. Mg(ClO3)2 sollte mit Vorsicht gehandhabt werden, um mögliche Gefahren zu vermeiden.
| Gefahrensymbole | Oxidationsmittel |
| Sicherheitsbeschreibung | Kontakt mit brennbaren Materialien vermeiden, Handschuhe und Schutzbrille tragen, für ausreichende Belüftung sorgen |
| UN-Identifikationsnummern | UN1475 |
| HS-Code | 2829.90.90 |
| Gefahrenklasse | 5.1 |
| Verpackungsgruppe | II |
| Toxizität | Kann Haut, Augen und Atemwege reizen; kann beim Verschlucken gesundheitsschädlich sein |
Methoden zur Magnesiumchlorat-Synthese
Zur Synthese von Mg(ClO3)2 können verschiedene Methoden eingesetzt werden.
Eine übliche Methode ist die Reaktion von Magnesiumhydroxid mit Chlorsäure. Die Reaktion läuft wie folgt ab:
Mg(OH)2 + 2HClO3 → Mg(ClO3)2 + 2H2O
Eine andere Methode besteht darin, Magnesiumcarbonat mit Perchlorsäure umzusetzen. Die Reaktion läuft wie folgt ab:
MgCO3 + 2HClO4 → Mg(ClO4)2 + CO2 + H2O
Eine dritte Methode beinhaltet die Elektrolyse von Magnesiumchlorid in Gegenwart eines Chloratsalzes wie Natrium- oder Kaliumchlorat. Die Reaktion läuft wie folgt ab:
2MgCl2 + 2NaClO3 → Mg(ClO3)2 + 2NaCl
Bei dieser Methode verwendet der Elektrolyseprozess eine Magnesiumanode und verwendet Chloratsalz als Oxidationsmittel.
Verwendung von Magnesiumchlorat
Mg(ClO3)2 hat vielfältige Einsatzmöglichkeiten in unterschiedlichen Bereichen. Hier sind einige seiner Anwendungen:
- Pyrotechnische Produkte: Wird häufig als Oxidationsmittel in pyrotechnischen Zusammensetzungen wie Fackeln, Feuerwerkskörpern und Signalgeräten verwendet.
- Chemische Synthese: Wird als Sauerstoffquelle bei der Synthese verschiedener Chemikalien verwendet, darunter Pharmazeutika, Farbstoffe und Sprengstoffe.
- Bleichmittel: Wird als Bleichmittel bei der Herstellung von Papier, Zellstoff und Textilien verwendet.
- Wasseraufbereitung: Wird auch als Wasseraufbereitungsmittel verwendet, um im Wasser vorhandene Verunreinigungen und Bakterien zu entfernen.
- Laborreagenz: Wird als Laborreagenz in verschiedenen Methoden der analytischen Chemie verwendet.
- Landwirtschaft: Wird als Dünger und Bodenverbesserer verwendet, um Pflanzen mit Magnesium und Sauerstoff zu versorgen.
- Öl- und Gasindustrie: Wird als Oxidationsmittel bei Bohr- und Sprengarbeiten in der Öl- und Gasindustrie verwendet.
Fragen:
F: Wie lautet die Formel für Magnesiumchlorat?
A: Mg(ClO3)2.
F: Wie viele Atome sind in 2,1 Mol Mg(ClO3)2 enthalten?
A: Es gibt 5,04 x 10^24 Atome in 2,1 Mol Mg(ClO3)2.
F: Wozu zerfällt Magnesiumchlorat?
A: Mg(ClO3)2 kann sich beim Erhitzen in Magnesiumchlorid, Sauerstoffgas und Chlorgas umwandeln.
F: Wie wird Magnesiumchlorat abgebaut?
A: Mg(ClO3)2 zerfällt beim Erhitzen in Magnesiumchlorid und Sauerstoffgas.
F: Wie viele Sauerstoffatome sind insgesamt in einer Einheit Mg(ClO3)2 vorhanden?
A: In einer Einheit Mg(ClO3)2 sind 6 Sauerstoffatome vorhanden.
F: In was zerfällt Mg(ClO3)2?
A: Mg(ClO3)2 zersetzt sich beim Erhitzen zu MgCl2 und O2.
F: Wie viele Mol Sauerstoffatome sind insgesamt in einem Mol Mg(ClO3)2 vorhanden?
A: In einem Mol Mg(ClO3)2 sind 6 Mol Sauerstoffatome vorhanden.
F: Wie groß ist die Masse von Mg(ClO3)2 in Gramm?
A: Die Formelmasse in Gramm Mg(ClO3)2 beträgt 232,21 g/mol.
F: Ist Mg(ClO3)2 ionisch oder molekular?
A: Mg(ClO3)2 ist eine ionische Verbindung.
