Propylen (C3H6) ist ein farbloses, brennbares Gas, das häufig bei der Herstellung von Kunststoffen und synthetischen Fasern verwendet wird. Es wird auch als Brennstoff in Schweiß- und Schneidbrennern verwendet.
| Name der IUPAC | Propen |
| Molekularformel | C3H6 |
| CAS-Nummer | 115-07-1 |
| Synonyme | Propylen, Methylethylen, Prop-1-en, Methylethylen |
| InChI | InChI=1S/C3H6/c1-3-2/h3H,1-2H3 |
Eigenschaften von Propylen
Propylenformel
Die chemische Formel für Propylen lautet C3H6. Das bedeutet, dass jedes Propylenmolekül drei Kohlenstoffatome und sechs Wasserstoffatome enthält. Die Formel ist bei chemischen Reaktionen wichtig, da sie die Anzahl und Art der in jedem Molekül vorhandenen Atome angibt. Die Propylenformel wird häufig bei der Herstellung von Kunststoffen, synthetischen Fasern und anderen Industriematerialien verwendet.
Propylen-Molmasse
Propen, auch Propen genannt, hat eine Molmasse von 42,08 g/mol. Das bedeutet, dass ein Mol Propenmoleküle 42,08 Gramm wiegt. Die Molmasse ist für chemische Berechnungen wichtig, da sie uns die Umrechnung zwischen Masse und Mol einer Substanz ermöglicht. Um die Molmasse von Propen zu berechnen, addieren wir die Atommassen seiner Atombestandteile: drei Kohlenstoffatome mit einer Masse von jeweils 12,01 amu und sechs Wasserstoffatome mit einer Masse von jeweils 1,01 amu.
Siedepunkt von Propylen
Der Siedepunkt von Propen liegt bei -47,6 °C (-53,7 °F). Das bedeutet, dass Propen bei normalem Atmosphärendruck siedet und sich bei -47,6 °C in ein Gas verwandelt. Der Siedepunkt ist eine wichtige physikalische Eigenschaft von Propen, da er die Bedingungen bestimmt, unter denen die Substanz von einer Flüssigkeit in einen Gaszustand übergeht. Aufgrund seines niedrigen Siedepunkts eignet sich Propen als Kältemittel und bei der Herstellung von Chemikalien.
Schmelzpunkt von Propylen
Propen hat keinen genau definierten Schmelzpunkt, da es beim Erhitzen einen allmählichen Übergang vom Feststoff in den flüssigen Zustand durchläuft. Der Schmelzbereich von Propen liegt jedoch bei etwa -185 bis -135 °C (-301 bis -211 °F). Das bedeutet, dass Propen bei etwa -185 °C zu schmelzen beginnt und bei etwa -135 °C vollständig schmilzt. Der Schmelzpunkt ist wichtig, um die Bedingungen zu bestimmen, unter denen Propen von einem Feststoff in eine Flüssigkeit übergeht.
Dichte von Propylen g/ml
Die Dichte von Propen beträgt 0,74 g/ml bei Raumtemperatur (25 °C). Das bedeutet, dass ein Milliliter Propen 0,74 Gramm wiegt. Die Dichte ist eine wichtige physikalische Eigenschaft von Propen, da sie dabei hilft, die Masse eines bestimmten Volumens der Substanz zu bestimmen. Die geringe Dichte von Propen macht es für Anwendungen nützlich, bei denen ein leichtes Material erforderlich ist.
Molekulargewicht von Propylen
Das Molekulargewicht von Propen beträgt 42,08 g/mol. Dieser Wert ist die Summe der Atomgewichte aller Atome in einem einzelnen Propenmolekül. Das Molekulargewicht ist eine wichtige Eigenschaft, da es uns ermöglicht, die Menge einer Substanz in Mol aus ihrer Masse zu berechnen oder umgekehrt.
Propylenstruktur
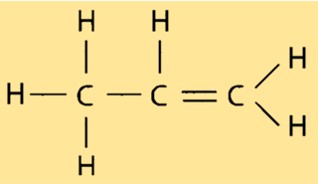
Propen hat eine lineare Molekülstruktur, wobei jedes Kohlenstoffatom an zwei Wasserstoffatome und ein weiteres Kohlenstoffatom gebunden ist. Die Doppelbindung zwischen den beiden Kohlenstoffatomen verleiht Propen seine reaktive Natur und macht es für verschiedene industrielle Anwendungen nützlich. Die Struktur von Propen ist wichtig für die Bestimmung seiner Eigenschaften, wie z. B. seines Siedepunkts und Schmelzpunkts.
| Aussehen | Farbloses Gas |
| Spezifisches Gewicht | 0,97 |
| Farbe | Farblos |
| Geruch | Leicht süßlicher Geruch, ähnlich wie Benzin |
| Molmasse | 42,08 g/Mol |
| Dichte | 0,74 g/ml (bei 25 °C) |
| Fusionspunkt | -185 bis -135 °C (-301 bis -211 °F) |
| Siedepunkt | -47,6°C (-53,7°F) |
| Blitzpunkt | -108°C (-162°F) |
| Löslichkeit in Wasser | 0,075 g/100 ml (bei 20°C) |
| Löslichkeit | Löslich in Aceton, Ethanol, Ether |
| Dampfdruck | 50,6 kPa (bei 25°C) |
| Wasserdampfdichte | 1,45 (bezogen auf Luft) |
| pKa | 44 |
| pH-Wert | Nicht anwendbar (Propylen ist weder sauer noch basisch) |
Sicherheit und Gefahren von Propylen
Propen gilt im Allgemeinen als relativ sicher zu handhabende Verbindung, birgt jedoch einige Gefahren. Es ist leicht entflammbar und kann leicht Feuer fangen. Es muss daher fern von Zündquellen gelagert und gehandhabt werden. Kontakt mit der Haut oder den Augen kann zu Reizungen führen und das Einatmen hoher Propenkonzentrationen kann zu Schwindel und sogar Bewusstlosigkeit führen. Wie bei jeder Chemikalie ist es wichtig, beim Umgang mit Propen die richtigen Sicherheitsverfahren einzuhalten, wie z. B. das Tragen von Schutzausrüstung wie Handschuhen und Schutzbrillen und die Gewährleistung einer ausreichenden Belüftung. Bei versehentlicher Exposition oder Verschlucken sofort einen Arzt aufsuchen.
| Gefahrensymbole | Leichtentzündlich (F+) |
| Sicherheitsbeschreibung | Von Zündquellen fernhalten. In gut belüfteten Bereichen verwenden. |
| UN-Identifikationsnummern | UN 1077 |
| HS-Code | 2901.10.00 |
| Gefahrenklasse | 2.1 (brennbares Gas) |
| Verpackungsgruppe | Gruppe A |
| Toxizität | Gilt nicht als giftig |
Propylen-Synthesemethoden
Verschiedene Methoden können Propen synthetisieren, darunter Kohlenwasserstoff-Dampfcracken, Propandehydrierung und katalytisches Wirbelschichtcracken.
Dampfcracken ist die gebräuchlichste Methode der Propensynthese. Dabei werden Kohlenwasserstoff-Ausgangsstoffe wie Ethan, Propan oder Naphtha in Gegenwart von Dampf auf hohe Temperaturen erhitzt. Der Prozess umfasst das Abkühlen und Trennen des resultierenden Kohlenwasserstoffgemisches, um das Propen als separates Produkt zu isolieren.
Die Propandehydrierung ist eine weitere Methode zur Synthese von Propen. Dabei wird Propan mit einem Katalysator umgesetzt, um Wasserstoff zu entfernen und Propen zu erzeugen. Diese Methode ist attraktiv, da Propan leicht verfügbar und kostengünstig ist.
Der Prozess des katalytischen Wirbelschichtcrackens verwendet einen Katalysator, um schwere Kohlenwasserstoffe in leichtere Produkte, einschließlich Propen, umzuwandeln, indem größere Moleküle in kleinere Moleküle zerlegt werden.
Verwendung von Propylen
Propen ist eine vielseitige Chemikalie, die in verschiedenen Branchen vielfältig eingesetzt werden kann. Hier sind einige der häufigsten Verwendungszwecke für Propen:
- Polypropylenproduktion: Spielt eine entscheidende Rolle als Primärrohstoff bei der Herstellung von Polypropylen, einem vielseitigen Material, das in verschiedenen Anwendungen wie Verpackungen, Textilien und Automobilteilen verwendet wird.
- Brennstoff: Wird in vielen industriellen Anwendungen als Brennstoff verwendet, beispielsweise beim Autogenschneiden und -schweißen.
- Lösungsmittel: Dient als nützliches Lösungsmittel für eine Vielzahl von Chemikalien und wird in vielen Anwendungen verwendet, einschließlich der Extraktion ätherischer Öle.
- Kältemittel: Wird in einigen Systemen als Kältemittel verwendet, insbesondere in Anwendungen, bei denen die Verwendung anderer Kältemittel eingeschränkt ist.
- Chemisches Zwischenprodukt: Wird als chemisches Zwischenprodukt bei der Herstellung vieler anderer Chemikalien wie Propylenoxid, Acrylnitril und Butyraldehyd verwendet.
- Lebensmittelverpackungen: werden bei der Herstellung von Lebensmittelverpackungsmaterialien wie Folien und Behältern verwendet.
- Körperpflegeprodukte: Viele Körperpflegeprodukte, wie Feuchtigkeitscremes und Haarpflegeprodukte, verwenden Propylenglykol, ein Propenderivat.
Fragen:
F: Welche Reaktion sollte verwendet werden, um Propen in Alkylhalogenid umzuwandeln?
A: Propen kann durch eine Reaktion mit Halogenwasserstoffen wie Chlorwasserstoff (HCl) oder Bromwasserstoff (HBr) in ein Alkylhalogenid umgewandelt werden.
F: Wie lautet die empirische Formel für Propen (c3h6)?
A: Die empirische Formel für Propen (C3H6) lautet CH2.
F: Ist Propen wasserlöslich?
A: Propen ist in Wasser nicht löslich, da es eine unpolare Verbindung und Wasser ein polares Lösungsmittel ist.
F: Wie lauten die Formelmassen von Propen, C3H6?
A: Die Formelmasse von Propen (C3H6) beträgt etwa 42,08 g/mol.
F: Wie lautet die empirische Formel für die folgende Summenformel: C3H6?
A: Die empirische Formel für C3H6 lautet CH2.
F: Wie konnten Sie experimentell zeigen, dass die Summenformel von Propen C3H6 und nicht CH2 lautet?
A: Eine experimentelle Methode zur Bestimmung der Summenformel von Propen besteht in der Analyse seiner Verbrennungsprodukte. Wenn Propen in einem Überschuss an Sauerstoff verbrannt wird, entstehen Kohlendioxid und Wasser. Durch Messung der erzeugten Kohlendioxid- und Wassermengen kann die Summenformel von Propen als C3H6 und nicht als CH2 ermittelt werden.
