Kupferchlorid oder Kupfer(I)-chlorid ist eine Verbindung mit der chemischen Formel CuCl, bestehend aus einem Kupferatom und einem Chloratom. Es ist ein weißer Feststoff mit kristalliner Struktur und wird in verschiedenen industriellen Anwendungen verwendet, beispielsweise als Katalysator und bei der Herstellung anderer Kupferverbindungen.
| IUPAC-Name | Kupfer(I)-chlorid |
| Molekularformel | CuCl |
| CAS-Nummer | 7758-89-6 |
| Synonyme | Kupfermonochlorid, Kupferchlorid (CuCl), Kupfer(I)chlorid, Kupferchlorid, Nantokit |
| InChI | InChI=1S/ClH.Cu/h1H;/q;+1/p-1 |
Kupfer(I)-Chlorid-Formel
Die Formel für Kupfer(I)-chlorid lautet CuCl. Dies weist darauf hin, dass jedes Kupfer(I)-chlorid-Molekül ein Kupferatom und ein Chloratom enthält. Mit der Formel lässt sich die Masse einer Kupfer(I)-chlorid-Probe oder die Anzahl der in einer Probe vorhandenen Mol Kupfer(I)-chlorid berechnen. Die Formel liefert auch Informationen über die relative Anzahl der in der Verbindung vorhandenen Atome, was für das Verständnis ihrer Eigenschaften und ihres Verhaltens nützlich ist.
Molmasse von Kupfer(I)-chlorid
Die Molmasse von Kupfer(I)-chlorid ist die Masse eines Mols der Verbindung. Sie wird durch Addition der Atommassen der Elemente berechnet, aus denen die Verbindung besteht. Kupfer(I)chlorid hat eine Molmasse von 98,99 g/mol. Dieser Wert kann zur Umrechnung zwischen der Masse einer Probe Kupfer(I)-chlorid und der Anzahl der in der Probe vorhandenen Mol verwendet werden.
Siedepunkt von Kupfer(I)-chlorid
Der Siedepunkt von Kupfer(I)-chlorid ist die Temperatur, bei der die Verbindung vom flüssigen in den gasförmigen Zustand übergeht. Kupfer(I)-chlorid hat einen relativ niedrigen Siedepunkt von 1.490 °C. Dies ist auf schwache intermolekulare Kräfte zwischen Kupfer(I)-chloridmolekülen zurückzuführen. Bei dieser Temperatur gewinnen die Moleküle genügend kinetische Energie, um die Anziehungskräfte zu überwinden, die sie in flüssiger Form zusammenhalten.
Schmelzpunkt von Kupfer(I)-chlorid
Der Schmelzpunkt von Kupfer(I)-chlorid ist die Temperatur, bei der die Verbindung vom Feststoff in den flüssigen Zustand übergeht. Kupfer(I)-chlorid hat einen relativ hohen Schmelzpunkt von 430°C. Dies liegt an den starken Ionenbindungen zwischen den Kupfer- und Chloratomen, aus denen die Verbindung besteht. Bei dieser Temperatur reicht die der Verbindung zugeführte Wärmeenergie aus, um die Ionenbindungen aufzubrechen und den Atomen die freie Bewegung in flüssiger Form zu ermöglichen.
Dichte von Kupfer(I)-chlorid g/ml
Die Dichte von Kupfer(I)-chlorid ist ein Maß für seine Masse pro Volumeneinheit. Kupfer(I)chlorid hat bei Raumtemperatur eine Dichte von 4,14 g/ml. Dieser Wert zeigt an, dass Kupfer(I)-chlorid eine dichte Substanz ist und in Flüssigkeiten fließt, die weniger dicht sind als es ist.
Molekulargewicht von Kupfer(I)-chlorid
Das Molekulargewicht von Kupfer(I)-chlorid ist die Summe der Atomgewichte der Atome in einem einzelnen Molekül der Verbindung. Kupfer(I)chlorid hat ein Molekulargewicht von 98,99 g/mol. Dieser Wert kann zur Umrechnung zwischen der Masse einer Kupfer(I)-Chlorid-Probe und der Anzahl der in der Probe vorhandenen Moleküle verwendet werden.
Struktur von Kupfer(I)-chlorid
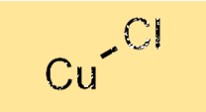
Kupfer(I)-chlorid hat eine Kristallstruktur, in der Kupferatome von vier Chloratomen in tetraedrischer Anordnung umgeben sind. Kupferatome sind durch Ionenbindungen mit Chloratomen verbunden, die durch die Übertragung von Elektronen von Kupferatomen auf Chloratome entstehen. Diese Struktur verleiht Kupfer(I)-chlorid seine charakteristischen Eigenschaften, wie seinen hohen Schmelzpunkt und seine Dichte.
| Aussehen | weißes kristallines Pulver |
| Spezifisches Gewicht | 4,14 g/cm³ |
| Farbe | Weiß |
| Geruch | Geruchlos |
| Molmasse | 98,99 g/Mol |
| Dichte | 4,14 g/cm³ |
| Fusionspunkt | 430°C |
| Siedepunkt | 1490°C |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | 0,0095 g/L bei 20 °C |
| Löslichkeit | Löslich in konzentrierter Salzsäure, Ammoniak und Kaliumcyanid. Unlöslich in Ethanol und Ether. |
| Dampfdruck | Unzutreffend |
| Wasserdampfdichte | Unzutreffend |
| pKa | Unzutreffend |
| pH-Wert | 4,6 – 5,8 (1%ige Lösung) |
Sicherheit und Gefahren von Kupferchlorid
Kupferchlorid birgt mehrere Sicherheits- und Gesundheitsrisiken. Beim Verschlucken ist es gesundheitsschädlich und kann zu Reizungen der Augen, der Haut und der Atemwege führen. Kupferchlorid kann auch Metallrauchfieber verursachen, eine Erkrankung, die durch grippeähnliche Symptome wie Fieber, Schüttelfrost und Husten gekennzeichnet ist. Eine langfristige Exposition gegenüber Kupferchlorid kann Lungenschäden und andere chronische Gesundheitsschäden verursachen. Beim Umgang mit Kupferchlorid ist es wichtig, Schutzkleidung, Handschuhe und Augenschutz zu tragen, um das Risiko einer Exposition zu minimieren. Bei Verschlucken oder versehentlicher Exposition sofort einen Arzt aufsuchen. Die ordnungsgemäße Handhabung, Lagerung und Entsorgung von Kupferchlorid ist erforderlich, um eine Umweltverschmutzung und eine Schädigung der menschlichen Gesundheit zu verhindern.
| Gefahrensymbole | Totenkopf |
| Sicherheitsbeschreibung | Nicht einnehmen. Tragen Sie Schutzkleidung, Handschuhe und Augenschutz. Bei Verschlucken oder Kontakt sofort einen Arzt aufsuchen. Sachgemäße Handhabung, Lagerung und Entsorgung erforderlich. |
| UN-Identifikationsnummern | UN 3077 |
| HS-Code | 28273910 |
| Gefahrenklasse | 6.1 |
| Verpackungsgruppe | II |
| Toxizität | Giftig bei Verschlucken oder Einatmen. Verursacht Haut- und Augenreizungen. Kann Lungenschäden und andere chronische Gesundheitsschäden verursachen. |
Methoden zur Synthese von Kupferchlorid
Es gibt verschiedene Methoden zur Synthese von Kupferchlorid:
Eine übliche Methode beinhaltet die Reaktion zwischen Kupfer und Salzsäure. Metallisches Kupfer reagiert mit Salzsäure unter Bildung von CuCl und Wasserstoffgas. CuCl kann durch Filtration und Trocknung gereinigt werden.
Eine andere Methode beinhaltet die Reaktion zwischen Kupferoxid und Salzsäure.
Um Kupferchlorid zu synthetisieren, kann Kupferoxid zu einer Salzsäurelösung gegeben werden, um CuCl2 herzustellen. Anschließend kann man das CuCl2 mit einem Reduktionsmittel wie Salzsäure oder Schwefeldioxid zu CuCl reduzieren.
Eine andere Methode zur Synthese von CuCl besteht darin, Kupfersulfat und Natriumchlorid in Wasser aufzulösen, die resultierende Lösung zu erhitzen und sie zu filtrieren, um Verunreinigungen zu entfernen. Nach dem Filtrieren der erhaltenen Lösung ist es möglich, sie abzukühlen, um CuCl-Kristalle zu bilden.
Eine Variation dieser Methode beinhaltet die Reaktion zwischen Kupfersulfat und Natriumchlorid in Gegenwart von Reduktionsmitteln wie Ascorbinsäure oder Glucose. Das Reduktionsmittel reduziert die Cu2+-Ionen im Kupfersulfat zu Cu+-Ionen, die dann mit den Chloridionen im Natriumchlorid zu CuCl reagieren.
Insgesamt bieten diese Methoden eine Reihe von Möglichkeiten zur Synthese von Kupferchlorid, wobei Variationen je nach verwendeten Rohstoffen und Bedingungen variieren. Bei der Synthese und Handhabung von Kupferchlorid müssen Sicherheits- und Umweltaspekte sorgfältig beachtet werden.
Verwendung von Kupferchlorid
Kupferchlorid hat verschiedene Anwendungen in verschiedenen Bereichen. Hier sind einige häufige Anwendungen von Kupferchlorid:
- Katalyse: Wird als Katalysator in verschiedenen chemischen Reaktionen verwendet, einschließlich der Synthese organischer Verbindungen wie Pharmazeutika und Agrochemikalien.
- Pigment: Wird als Pigment in der Keramik- und Glasindustrie verwendet. Es verleiht den Produkten eine grüne Farbe.
- Antifouling-Mittel: Wird als Antifouling-Mittel in Meeresanwendungen verwendet, um das Wachstum von Seepocken, Algen und anderen Meeresorganismen auf Schiffen und Booten zu verhindern.
- Fotografie: Wird als fotografischer Entwickler zur Erstellung von Schwarzweißbildern verwendet. Es wird als Reduktionsmittel verwendet, um Silberionen in metallisches Silber umzuwandeln.
- Galvanisieren: Wird beim Galvanisieren verwendet, um eine Kupferschicht auf einem Substrat abzuscheiden. Es wird bei der Herstellung von elektronischen Bauteilen, Schmuck und anderen Produkten verwendet.
- Fungizid: Wird als Fungizid zum Schutz von Pflanzen vor Pilzkrankheiten eingesetzt.
- Löten: Wird beim Schweißen verwendet, um vor dem Schweißen Oxidschichten von Metalloberflächen zu entfernen.
- Ätzen: Wird als Ätzmittel bei der Herstellung von Leiterplatten und anderen elektronischen Bauteilen verwendet.
Kupfer(I)-chlorid wird aufgrund seiner besonderen Eigenschaften häufig in verschiedenen Industriezweigen eingesetzt. Die Industrie nutzt es in verschiedenen Anwendungen, von der Katalyse bis hin zu Schiffsbeschichtungen.
Fragen:
F: Ist CuCl wasserlöslich?
A: Ja, CuCl ist in Wasser leicht löslich, mit einer Löslichkeit von etwa 0,67 g/L bei Raumtemperatur.
F: Ist CuCl löslich?
A: CuCl ist in Wasser schwer löslich, in organischen Lösungsmitteln wie Ethanol und Ether jedoch unlöslich.
F: Wie heißt CuCl?
A: Der Name von CuCl ist Kupferchlorid.
F: Was verursacht die Blasen, wenn Aluminium in eine CuCl-Lösung gegeben wird? A: Wenn Aluminium in eine CuCl-Lösung gegeben wird, kommt es zu einer Redoxreaktion, bei der das Aluminium die Cu2+-Ionen in CuCl zu Cu+-Ionen reduziert und dabei Aluminiumchlorid (AlCl3) und metallisches Kupfer (Cu) bildet. Bei den beobachteten Blasen handelt es sich um Wasserstoffgas (H2), das als Nebenprodukt der Reaktion zwischen Aluminium und in der Lösung vorhandenen Wassermolekülen entsteht.
