Natriumsulfat ist eine weiße kristalline Verbindung mit der Formel Na2SO4. Es wird in der Waschmittel-, Papier- und Glasindustrie als Füllstoff, Trocknungsmittel und Entschäumer eingesetzt.
| IUPAC-Name | Dinatriumsulfat |
| Molekularformel | Na2SO4 |
| CAS-Nummer | 7757-82-6 |
| Synonyme | Dinatriumsulfat, wasserfreies Natriumsulfat, Natriumsulfat |
| InChI | InChI=1S/2Na.H2O4S/c;;1-5(2,3)4/h;;(H2,1,2,3,4)/q2*+1;/p-2 |
Na2So4 Molmasse
Natriumsulfat hat eine Molmasse von 142,04 g/mol. Es ist eine ionische Verbindung, die aus zwei Natriumkationen (Na+) und einem Sulfatanion (SO42-) besteht. Die Molmasse wird durch Addition der Atommassen aller Atome in einem Natriumsulfatmolekül berechnet. In diesem Fall haben wir zwei Natriumatome mit einer Masse von jeweils 22,99 g/mol, ein Schwefelatom mit einer Masse von 32,06 g/mol und vier Sauerstoffatome mit einer Masse von jeweils 15,99 g/mol. Addiert man sie zusammen, erhält man die Molmasse von Natriumsulfat.
Siedepunkt von Natriumsulfat
Natriumsulfat hat einen hohen Siedepunkt von 1.429 °C (2.604 °F). Dies liegt an der ionischen Natur der Verbindung, die starke elektrostatische Anziehungskräfte zwischen den positiv geladenen Natriumionen und den negativ geladenen Sulfationen erzeugt. Um diese Kräfte zu überwinden, ist viel Energie erforderlich, weshalb der Siedepunkt von Natriumsulfat so hoch ist.
Schmelzpunkt von Natriumsulfat
Der Schmelzpunkt von Natriumsulfat variiert je nach Wassergehalt. Wasserfreies Natriumsulfat (ohne Wasser) hat einen Schmelzpunkt von 884 °C (1.623 °F). Allerdings schmilzt Natriumsulfat-Decahydrat (mit zehn Wassermolekülen) bei einer niedrigeren Temperatur von 32,4 °C (90,3 °F). Das Vorhandensein von Wassermolekülen in der Kristallstruktur von Natriumsulfat-Decahydrat schwächt die Ionenbindungen zwischen Natrium- und Sulfationen und senkt den Schmelzpunkt.
Dichte von Natriumsulfat g/ml
Die Dichte von Natriumsulfat variiert je nach Form. Wasserfreies Natriumsulfat hat eine Dichte von 2,664 g/cm3, während Natriumsulfat-Decahydrat eine Dichte von 1,464 g/cm3 hat. Der Dichteunterschied ist auf das Vorhandensein von Wassermolekülen in der Kristallstruktur des Decahydrats zurückzuführen, die sein Volumen erhöhen und seine Dichte verringern.
Molekulargewicht von Natriumsulfat
Das Molekulargewicht von Natriumsulfat beträgt 142,04 g/mol. Dies ist die Masse eines Natriumsulfatmoleküls, bestehend aus zwei Natriumionen und einem Sulfation.
Struktur von Natriumsulfat
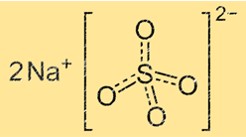
Natriumsulfat hat eine Kristallstruktur, die aus wiederkehrenden Einheiten von Natrium- und Sulfationen besteht. Das Sulfation ist ein Tetraeder mit vier Sauerstoffatomen an den Ecken und einem Schwefelatom in der Mitte. Das Natriumion ist eine kleine Kugel, die sich zwischen den Sulfationen befindet. Die Kristallstruktur von Natriumsulfat kann je nach Wassergehalt variieren. Wasserfreies Natriumsulfat hat eine andere Kristallstruktur als Natriumsulfat-Decahydrat.
Natriumsulfat-Formel
Die chemische Formel für Natriumsulfat lautet Na2SO4. Das bedeutet, dass jedes Natriumsulfatmolekül zwei Natriumionen (Na+) und ein Sulfation (SO42-) enthält. Die Formel stellt das einfachste ganzzahlige Verhältnis von Atomen in einem Molekül der Verbindung dar.
| Aussehen | Weißer kristalliner Feststoff |
| Spezifisches Gewicht | 2.664 g/cm3 (wasserfrei), 1.464 g/cm3 (Decahydrat) |
| Farbe | Weiß |
| Geruch | Geruchlos |
| Molmasse | 142,04 g/Mol |
| Dichte | 2.664 g/cm3 (wasserfrei), 1.464 g/cm3 (Decahydrat) |
| Fusionspunkt | 884°C (wasserfrei), 32,4°C (Decahydrat) |
| Siedepunkt | 1.429°C |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | 44,1 g/100 ml (wasserfrei), 47,6 g/100 ml (Decahydrat) |
| Löslichkeit | Löslich in Wasser, unlöslich in Ethanol |
| Dampfdruck | 0,01 mmHg bei 20°C |
| Wasserdampfdichte | Unzutreffend |
| pKa | 1. Platz: 2,01, 2. Platz: 7,20, 3. Platz: 9,41 |
| pH-Wert | 9-11 (10 %ige Lösung) |
Sicherheit und Gefahren von Natriumsulfat
Natriumsulfat gilt im Allgemeinen als sicher in der Anwendung, kann jedoch unter bestimmten Umständen Reizungen oder Schäden verursachen. Bei Kontakt oder Einatmen kann es zu Reizungen der Haut, der Augen und der Atemwege kommen. Das Verschlucken großer Mengen kann zu Übelkeit, Erbrechen und Durchfall führen. Es kann auch schädlich für Wasserlebewesen sein, wenn es in Gewässer gelangt. Natriumsulfat gilt nicht als brennbarer oder explosiver Stoff. Wenn es jedoch erhitzt oder hohen Temperaturen ausgesetzt wird, können giftige Dämpfe freigesetzt werden. Es ist wichtig, die richtigen Handhabungsverfahren einzuhalten, Schutzausrüstung zu tragen und Natriumsulfat an einem sicheren Ort aufzubewahren.
| Gefahrensymbole | Keiner |
| Sicherheitsbeschreibung | S24/25: Kontakt mit Haut und Augen vermeiden. S36/37: Geeignete Schutzkleidung und Handschuhe tragen. |
| UN-Identifikationsnummern | UN 2118 |
| HS-Code | 2833.11.00 |
| Gefahrenklasse | Nicht gefährlich |
| Verpackungsgruppe | Unzutreffend |
| Toxizität | LD50 (oral, Ratte): 5.900 mg/kg |
Methoden zur Synthese von Natriumsulfat
Es gibt verschiedene Methoden zur Synthese von Natriumsulfat, einschließlich der Reaktion von Natriumchlorid mit Schwefelsäure oder der Reaktion von Natriumhydroxid mit Schwefelsäure.
Bei der Herstellung von Natriumsulfat entstehen durch die Reaktion von Natriumchlorid und Schwefelsäure Natriumsulfat und Chlorwasserstoffgas. Der Prozess minimiert schädliche Dämpfe, indem die exotherme Reaktion unter kontrollierten Bedingungen durchgeführt wird. Anschließend wird die Lösung filtriert und anschließend eingedampft, um Natriumsulfatkristalle zu erzeugen.
Bei der Synthese von Natriumsulfat werden auch Schwefelsäure und Natriumhydroxid zu Natriumsulfat und Wasser kombiniert. Die Reaktion ist exotherm und erfordert eine sorgfältige Handhabung, um ein Überlaufen zu vermeiden. Nach dem Filtrieren der Mischung wird die resultierende Lösung eingedampft, um Natriumsulfatkristalle zu ergeben.
Eine andere Methode beinhaltet die Reaktion von Natriumcarbonat mit Schwefelsäure, wobei Natriumsulfat, Wasser und Kohlendioxid entstehen. Bei dieser Methode ist aufgrund der Freisetzung giftiger Dämpfe die Verwendung eines Abzugs erforderlich. Die Lösung wird dann filtriert und eingedampft, um Natriumsulfatkristalle zu erhalten.
Bei anderen industriellen Prozessen wie der Herstellung von Viskose, Waschmitteln und Glas entsteht ebenfalls Natriumsulfat als Nebenprodukt. Bei diesen Prozessen entsteht Natriumsulfat als Abfall, der gereinigt und für andere Zwecke wiederverwendet werden kann.
Verwendung von Natriumsulfat
Natriumsulfat hat ein breites Anwendungsspektrum in verschiedenen Branchen, darunter:
- Reinigungsmittel: Wird als Füllstoff in pulverförmigen Reinigungsmitteln verwendet und trägt dazu bei, das Volumen zu erhöhen und den Produktfluss zu verbessern.
- Glas: Wird als Flussmittel bei der Glasherstellung verwendet und trägt dazu bei, den Schmelzpunkt zu senken und die Klarheit des Endprodukts zu verbessern.
- Textilien: Wird bei der Herstellung synthetischer Fasern wie Rayon verwendet, um die Festigkeit und Haltbarkeit des Materials zu verbessern.
- Papier: Wird als Aufschlussmittel bei der Papierherstellung verwendet und hilft dabei, Holzfasern aufzuspalten und Verunreinigungen zu entfernen.
- Lebensmittel: Wird als Lebensmittelzusatzstoff verwendet, hauptsächlich als Verdickungsmittel und Emulgator in verarbeiteten Lebensmitteln.
- Pharmazeutika: Wird bei der Herstellung bestimmter Medikamente wie Abführmittel zur Behandlung von Verstopfung verwendet.
- Chemikalien: Wird bei der Herstellung verschiedener Chemikalien verwendet, darunter Natriumsulfid, Natriumsilikat und Natriumbicarbonat.
- Wasseraufbereitung: Wird in Wasseraufbereitungsanlagen verwendet, um Kalzium- und Magnesiumionen aus hartem Wasser zu entfernen.
- Ölbohren: Wird beim Ölbohren als Beschwerungsmittel verwendet und hilft dabei, die Dichte der Bohrflüssigkeit zu kontrollieren.
Fragen:
F: Wie lautet die Formel für Natriumsulfat?
A: Die chemische Formel für Natriumsulfat lautet Na2SO4.
F: Was ist Natriumsulfat?
A: Natriumsulfat ist ein weißer kristalliner Feststoff, der häufig in einer Vielzahl industrieller Anwendungen verwendet wird, darunter Reinigungsmittel, Glas, Textilien, Papier und Lebensmittel.
F: Ist Natriumsulfat sauer oder basisch?
A: Natriumsulfat ist weder sauer noch basisch; es ist eine neutrale Verbindung.
F: Welche Farbe hat Natriumsulfat? A: Natriumsulfat ist ein weißer kristalliner Feststoff und daher farblos.
