Acetophenon oder Methylphenylketon ist eine aromatische organische Verbindung mit der Formel C8H8O. Es wird bei der Herstellung von Parfümen und Harzen sowie als Lösungsmittel und Zwischenprodukt in Arzneimitteln verwendet.
| IUPAC-Name | 1-Phenylethanon |
| Molekularformel | C8H8O |
| CAS-Nummer | 98-86-2 |
| Synonyme | Methylphenylketon, Phenylmethylketon, AP, Acetylbenzol, Benzoylmethyl, Ethylphenylketon, Hypnon |
| InChI | InChI=1S/C8H8O/c1-7(9)8-5-3-2-4-6-8/h2-6H,1H3 |
Struktur von Acetophenon
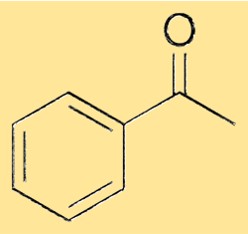
Die Struktur von Acetophenon besteht aus einer Phenylgruppe, die über eine Einfachbindung mit einer Carbonylgruppe verbunden ist. Die Carbonylgruppe besteht aus einem Kohlenstoffatom, das doppelt an ein Sauerstoffatom gebunden ist. Die Phenylgruppe ist ein sechsgliedriger Ring aus Kohlenstoffatomen, an den fünf Wasserstoffatome gebunden sind, und die sechste Position wird vom Carbonylkohlenstoffatom besetzt. Diese Struktur verleiht Acetophenon seine charakteristischen Eigenschaften und ermöglicht es ihm, als vielseitiger Rohstoff für die Synthese einer Vielzahl von Chemikalien zu dienen.
Schmelzpunkt von Acetophenon
Acetophenon hat einen Schmelzpunkt von -15,7 °C. Der Schmelzpunkt ist die Temperatur, bei der ein Feststoff bei konstantem Druck flüssig wird. Acetophenon ist bei Raumtemperatur ein kristalliner Feststoff und hat im Vergleich zu anderen ähnlichen Verbindungen einen relativ niedrigen Schmelzpunkt. Der Schmelzpunkt einer Verbindung wird durch ihre molekulare Struktur und die Stärke ihrer intermolekularen Kräfte bestimmt.
IR-Spektrum von Acetophenon
Das IR-Spektrum von Acetophenon zeigt charakteristische Peaks bei 1705 cm^-1, was der Carbonylgruppe entspricht, und bei 3030–3100 cm^-1, was der Streckung von aromatischem CH entspricht. Diese Peaks liefern wichtige Informationen über die im Molekül vorhandenen funktionellen Gruppen.
Molmasse von Acetophenon:
Acetophenon hat eine Molmasse von 120,15 g/mol. Es ist eine aromatische organische Verbindung mit einer Carbonylgruppe, die an einen Phenylring gebunden ist. Die Molmasse ist die Summe der Atommassen der Atome, die in einem Mol der Verbindung enthalten sind. Im Fall von Acetophenon besteht es aus 8 Kohlenstoffatomen, 8 Wasserstoffatomen und einem Sauerstoffatom, was insgesamt 17 Atome in einem Molekül ergibt. Die Molmasse ist eine wichtige Eigenschaft einer Verbindung, da sie zur Berechnung der Stoffmenge in einer bestimmten Probe verwendet wird, die für verschiedene Anwendungen in Chemie und Industrie erforderlich ist.
Siedepunkt von Acetophenon
Acetophenon hat einen Siedepunkt von 202 °C. Der Siedepunkt ist die Temperatur, bei der eine Flüssigkeit bei konstantem Druck in ein Gas übergeht. Acetophenon ist eine flüchtige organische Verbindung und hat im Vergleich zu anderen ähnlichen Verbindungen einen relativ hohen Siedepunkt. Der Siedepunkt einer Verbindung wird durch die Stärke ihrer intermolekularen Kräfte bestimmt, das sind die Kräfte, die Moleküle im flüssigen oder festen Zustand zusammenhalten. Im Fall von Acetophenon verfügt es über eine polare Carbonylgruppe, die mit anderen Acetophenonmolekülen Wasserstoffbrückenbindungen bilden kann, was die intermolekularen Kräfte verstärkt und den Siedepunkt erhöht.
Dichte von Methylphenylketon g/ml
Methylphenylketon hat bei Raumtemperatur eine Dichte von 1,03 g/ml. Die Dichte ist die Masse einer Substanz pro Volumeneinheit. Methylphenylketon ist bei Raumtemperatur flüssig und hat im Vergleich zu anderen ähnlichen Verbindungen eine relativ hohe Dichte. Die Dichte einer Verbindung wird durch ihr Molekulargewicht und die Dichte ihrer Moleküle in einem bestimmten Volumen bestimmt. Im Fall von Methylphenylketon hat es ein relativ hohes Molekulargewicht und eine relativ kompakte Molekülstruktur, was die Packung seiner Moleküle effizienter macht und die Dichte erhöht.
Molekulargewicht von Methylphenylketon
Methylphenylketon hat ein Molekulargewicht von 120,15 g/mol. Das Molekulargewicht ist die Summe der Atomgewichte aller Atome in einem Molekül. Methylphenylketon hat 8 Kohlenstoffatome, 8 Wasserstoffatome und ein Sauerstoffatom, was insgesamt 17 Atome in einem Molekül ergibt. Das Molekulargewicht ist eine wichtige Eigenschaft einer Verbindung, da es zur Berechnung der Stoffmenge in einer bestimmten Probe verwendet wird, die für verschiedene Anwendungen in Chemie und Industrie erforderlich ist.
| Aussehen | Farblose bis hellgelbe Flüssigkeit |
| Spezifisches Gewicht | 1,028–1,031 bei 25 °C |
| Farbe | Farblos bis hellgelb |
| Geruch | Süß, blumig, honigsüß |
| Molmasse | 120,15 g/Mol |
| Dichte | 1,03 g/ml bei 25 °C |
| Fusionspunkt | -15,7°C |
| Siedepunkt | 202°C |
| Blitzpunkt | 78°C |
| Löslichkeit in Wasser | 3,3 g/L bei 25°C |
| Löslichkeit | Löslich in Alkohol, Ether, Chloroform und Benzol |
| Dampfdruck | 0,27 mmHg bei 25°C |
| Wasserdampfdichte | 4,15 (Luft = 1) |
| pKa | 10.01 |
| pH-Wert | Nicht anwendbar (Methylphenylketon ist weder eine Säure noch eine Base) |
Sicherheit und Gefahren von Methylphenylketon
Methylphenylketon kann bei unsachgemäßer Handhabung gefährlich sein. Bei Kontakt oder Einatmen kann es zu Reizungen der Haut, Augen und Atemwege kommen. Direkter Kontakt mit hohen Konzentrationen von Methylphenylketon-Dämpfen kann Kopfschmerzen, Schwindel oder Übelkeit verursachen. Die Einnahme von Methylphenylketon kann zu Magen-Darm-Reizungen, Erbrechen oder Durchfall führen. Methylphenylketon ist außerdem brennbar und kann mit Luft explosionsfähige Gemische bilden. Es sollte an einem kühlen, trockenen und gut belüfteten Ort fern von Zündquellen gelagert werden. Beim Umgang mit Methylphenylketon sollte persönliche Schutzausrüstung wie Handschuhe, Schutzbrille und Atemschutzmaske getragen werden.
| Gefahrensymbole | Xi: Reizend, F: Leichtentzündlich |
| Sicherheitsbeschreibung | S16: Von Zündquellen fernhalten – nicht rauchen, S26: Bei Augenkontakt sofort mit viel Wasser spülen und Arzt konsultieren, S36: Geeignete Schutzkleidung tragen, S37: Geeignete Handschuhe tragen, S39: Geeignete Handschuhe tragen Schutzkleidung. Gesichtsschutz |
| UN-Identifikationsnummern | UN 2319 |
| HS-Code | 291439 |
| Gefahrenklasse | 3 (Brennbare Flüssigkeiten) |
| Verpackungsgruppe | III |
| Toxizität | Methylphenylketon wird als Augenreizmittel der Kategorie 3 und als Hautreizmittel der Kategorie 4 eingestuft. Es gilt nicht als krebserregend oder mutagen. Die orale LD50 (tödliche Dosis für 50 % der getesteten Personen) beträgt bei Ratten etwa 3.000 mg/kg. Es wird nicht als erhebliches Umweltrisiko angesehen. |
Methoden zur Synthese von Methylphenylketon
Es gibt verschiedene Methoden zur Synthese von Methylphenylketon.
Eine gängige Methode ist die Friedel-Crafts-Acylierung von Benzol mit Acetylchlorid in Gegenwart eines Lewis-Säure-Katalysators wie Aluminiumchlorid. Bei dieser Reaktion entstehen Methylphenylketon und Chlorwasserstoff als Nebenprodukte.
Eine andere Methode ist die Oxidation von Ethylbenzol mit Luft oder Sauerstoff in Gegenwart eines Metallkatalysators wie Kobalt oder Mangan. Bei dieser Reaktion entstehen Methylphenylketon und Essigsäure als Nebenprodukte.
Methylphenylketon kann durch Reduktion von Phenylaceton mit Reduktionsmitteln wie Natriumborhydrid oder Lithiumaluminiumhydrid synthetisiert werden. Bei dieser Reaktion entstehen als Nebenprodukte Methylphenylketon und der entsprechende Alkohol.
Eine andere Methode beinhaltet die Reaktion von Benzoylchlorid mit Ethylbenzol in Gegenwart eines Aluminiumchlorid-Katalysators, um Methylphenylketon und Chlorwasserstoff als Nebenprodukte zu erzeugen.
Verwendung von Methylphenylketon
Methylphenylketon wird in verschiedenen Branchen vielfältig eingesetzt.
- Methylphenylketon wird häufig als Lösungsmittel für verschiedene Harze, Celluloseester und Kunststoffe verwendet.
- Die Lebensmittelindustrie verwendet Methylphenylketon als Aromastoff, insbesondere für Kirsch- und Mandelaromen.
- Die Parfümindustrie verwendet Methylphenylketon als Rohstoff für die Herstellung von Parfüms und anderen Duftprodukten.
- Mit Methylphenylketon werden verschiedene Chemikalien wie Pharmazeutika, Agrochemikalien und Farbstoffe synthetisiert.
- Methylphenylketon dient als Zwischenprodukt bei der Herstellung von Phenylaceton, einem Vorläufer für die Synthese von Amphetaminen.
- Cumarin, ein Duftstoff, der in Seifen und Waschmitteln verwendet wird, wird aus Methylphenylketon synthetisiert.
- Reagenzien der organischen Chemie verwenden Methylphenylketon als Reagenz für die Synthese verschiedener Verbindungen.
- Methylphenylketon dient als Rohstoff für die Herstellung anderer Chemikalien wie Styrol und Methylstyrol.
Insgesamt hat Methylphenylketon aufgrund seiner vielseitigen Eigenschaften und Verwendungsmöglichkeiten ein breites Anwendungsspektrum in verschiedenen Branchen.
Fragen:
F: Ist Acetophenon polar?
A: Ja, Acetophenon ist aufgrund der Anwesenheit einer Carbonylgruppe (C=O) und eines Phenylrings polar, wodurch ein Dipolmoment entsteht.
F: Ist Benzaldehyd oder Acetophenon polarer?
A: Benzaldehyd ist polarer als Acetophenon, da es aufgrund der Anwesenheit einer Aldehydgruppe (CHO) zusätzlich zum Phenylring ein höheres Dipolmoment aufweist.
F: IR-Spektrum von Acetophenon?
A: Das IR-Spektrum von Acetophenon zeigt eine starke und breite Absorptionsbande um 1700 cm^-1, die charakteristisch für die Streckschwingung von Carbonyl (C=O) ist. Es zeigt auch Spitzen um 3000–3100 cm^-1, was den Streckschwingungen von aromatischem CH entspricht.
F: Von Acetophenon zu Benzoesäure?
A: Acetophenon kann durch Oxidation mit einem Oxidationsmittel wie Kaliumpermanganat oder Chromsäure in Benzoesäure umgewandelt werden. Diese Reaktion führt zur Spaltung der Kohlenstoff-Kohlenstoff-Bindung neben der Carbonylgruppe, gefolgt von der Oxidation des resultierenden Zwischenprodukts zur Bildung von Benzoesäure.
F: Von Benzol zu Acetophenon?
A: Benzol kann durch Friedel-Crafts-Acylierung unter Verwendung von Acetylchlorid oder Essigsäureanhydrid in Gegenwart eines Lewis-Säure-Katalysators wie Aluminiumchlorid in Acetophenon umgewandelt werden. Diese Reaktion führt zur Substitution eines Wasserstoffatoms von Benzol durch eine Acetylgruppe (-COCH3), gefolgt von einer Umlagerung unter Bildung von Acetophenon.
