Chlorsäure (HClO3) ist eine starke, instabile Säure, die durch Mischen von Chlordioxid mit Wasser hergestellt werden kann. Es wird in Bleich- und Desinfektionsmitteln sowie bei der Herstellung von Sprengstoffen eingesetzt.
| IUPAC-Name | Chlorsäure |
| Molekularformel | HClO3 |
| CAS-Nummer | 7790-93-4 |
| Synonyme | Perchlorsäure, Chlorat; Chlorsäurelösung; Chlorsäure (V); Chlorwasserstoff; Wasserstofftrichlorat |
| InChI | InChI=1S/ClHO3/c2-1(3)4/h(H,2,3,4) |
Die Eigenschaften von Chlorsäure (HClO3) sind aufgrund ihrer vielfältigen industriellen Anwendungen für Chemiker und Ingenieure von besonderem Interesse.
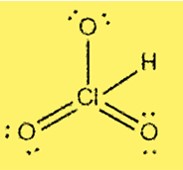
Lewis-Struktur HClO3
Die Lewis-Struktur von HClO3 zeigt, dass Chlor das Zentralatom ist, das an drei Sauerstoffatome und ein Wasserstoffatom gebunden ist. Chlor hat 7 Valenzelektronen und jeder Sauerstoff hat 6 Valenzelektronen. Die Struktur umfasst drei Einfachbindungen und eine Doppelbindung zwischen Chlor- und Sauerstoffatomen.
Formel für Chlorsäure (HClO3).
Die chemische Formel für Chlorsäure (HClO3) lautet HClO3. Es handelt sich um eine anorganische Säure, die ein Chloratom, ein Wasserstoffatom und drei Sauerstoffatome enthält. Die Formel für Chlorsäure (HClO3) wird zur Berechnung der Stöchiometrie und Konzentration von Lösungen, die die Säure enthalten, verwendet.
Molmasse von Chlorsäure (HClO3).
Die Molmasse von Chlorsäure (HClO3) beträgt 84,46 g/mol. Es ist eine relativ leichte Säure im Vergleich zu anderen anorganischen Säuren, wie beispielsweise Schwefelsäure, die eine Molmasse von 98,08 g/mol hat. Die Molmasse von Chlorsäure (HClO3) ist ein wichtiger Parameter bei der Berechnung der Konzentration und Stöchiometrie von Lösungen, die die Säure enthalten.
Siedepunkt von Chlorsäure (HClO3)
Chlorsäure (HClO3) hat einen Siedepunkt von 40,5 °C. Es handelt sich um eine sehr flüchtige Säure, die sich bei hohen Temperaturen zersetzen kann, was ihre Handhabung und Lagerung erschwert. Der niedrige Siedepunkt von Chlorsäure (HClO3) ist ein wichtiger Gesichtspunkt bei der Konstruktion von Geräten und Prozessen, bei denen die Säure verwendet wird.
Schmelzpunkt von Chlorsäure (HClO3)
Chlorsäure (HClO3) hat keinen genau definierten Schmelzpunkt. Es kann sich zersetzen, bevor es seinen Schmelzpunkt erreicht, wobei Sauerstoffgas freigesetzt wird und Chloratrückstände zurückbleiben. Das Fehlen eines eindeutigen Schmelzpunkts ist auf die Instabilität von Chlorsäure (HClO3) zurückzuführen.
Dichte von Chlorsäure (HClO3) g/ml
Die Dichte von Chlorsäure (HClO3) beträgt 1,97 g/cm³. Es ist eine relativ dichte Säure im Vergleich zu anderen anorganischen Säuren, wie beispielsweise Salzsäure, die eine Dichte von 1,18 g/cm³ hat. Die hohe Dichte von Chlorsäure (HClO3) ist ein wichtiger Gesichtspunkt bei der Gestaltung von Prozessen zur Handhabung und zum Transport von Säure.
Molekulargewicht von Chlorsäure (HClO3)
Das Molekulargewicht von Chlorsäure (HClO3) beträgt 84,46 g/mol. Es ist die Summe der Atomgewichte seiner Bestandteile: ein Chloratom, ein Wasserstoffatom und drei Sauerstoffatome. Das Molekulargewicht von Chlorsäure (HClO3) ist ein wichtiger Parameter bei der Berechnung der Konzentration und Stöchiometrie von Lösungen, die die Säure enthalten.
Struktur von Chlorsäure (HClO3)
Die Struktur der Chlorsäure besteht aus einem zentralen Chloratom, an das drei Sauerstoffatome und ein Wasserstoffatom gebunden sind. Das Molekül hat eine tetraedrische Geometrie, wobei sich das Chloratom im Zentrum des Tetraeders befindet. Die drei Sauerstoffatome sind trigonal-planar um das Chloratom angeordnet, während das Wasserstoffatom an eines der Sauerstoffatome gebunden ist. Die Struktur von Chlorsäure (HClO3) ist wichtig für das Verständnis ihrer chemischen Eigenschaften und Reaktivität.
| Aussehen | Klare oder gelbliche Flüssigkeit |
| Spezifisches Gewicht | 1,97 |
| Farbe | Farblos bis gelb |
| Geruch | Geruchlos |
| Molmasse | 84,46 g/Mol |
| Dichte | 1,68 g/cm³ |
| Fusionspunkt | Zersetzt sich vor dem Schmelzen |
| Siedepunkt | 40,5°C |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Mischbar |
| Löslichkeit | Löslich in den meisten organischen Lösungsmitteln |
| Dampfdruck | Unzutreffend |
| Wasserdampfdichte | Unzutreffend |
| PKa | -0,6 |
| PH | <1 |
Chlorsäure (HClO3) Sicherheit und Gefahren
Chlorsäure (HClO3) birgt mehrere Sicherheitsrisiken und sollte mit Vorsicht gehandhabt werden. Es ist ein starkes Oxidationsmittel, das mit vielen organischen Materialien, einschließlich Kraftstoffen, Reduktionsmitteln und brennbaren Flüssigkeiten, heftig reagieren kann. Es kann bei Kontakt schwere Verbrennungen an Haut und Augen verursachen und kann auf Metalloberflächen korrodierend wirken. Das Einatmen der Dämpfe kann zu Reizungen der Atemwege und Husten führen. Aufgrund seiner reaktiven Natur sollte es in einem gut belüfteten Bereich, entfernt von anderen Chemikalien, gelagert und gehandhabt werden. Beim Umgang mit Chlorsäure sollte Schutzausrüstung wie Handschuhe, Schutzbrille und Atemschutzmaske getragen werden, um eine Exposition zu vermeiden. Bei Haut- oder Augenkontakt sollte sofort ein Arzt aufgesucht werden.
| Gefahrensymbole | Oxidationsmittel |
| Sicherheitsbeschreibung | Kontakt mit Haut und Augen vermeiden; Schutzausrüstung tragen |
| AN-Kennungen | UN 3084 |
| HS-Code | 2811.19 |
| Gefahrenklasse | 5.1 |
| Verpackungsgruppe | II |
| Toxizität | Ätzend; kann schwere Verätzungen der Haut und der Augen verursachen |
Methoden zur Synthese von Chlorsäure (HClO3)
Chlorsäure kann auf verschiedene Weise synthetisiert werden, einschließlich der Reaktion von Chlorgas mit Natriumhydroxid oder Natriumchlorat. Eine gängige Methode ist die Reaktion von Natriumchlorat mit Salzsäure.
Die Chlorsäure-Synthesereaktion umfasst die Reaktion von Natriumchlorat (NaClO3) mit Salzsäure (HCl) in einem zweistufigen Prozess. Der erste Schritt umfasst die Umwandlung von Natriumchlorat in Natriumchlorit (NaClO2) und Chlordioxid (ClO2)-Gas in Gegenwart eines Säurekatalysators. Im zweiten Schritt reagiert Chlordioxidgas mit überschüssiger Salzsäure zu Chlorsäure und Chlorgas.
Eine andere Methode zur Synthese von Chlorsäure umfasst die Elektrolyse einer Lösung, die Natriumchlorid, Salpetersäure und Schwefelsäure enthält. Bei diesem Prozess entsteht Chlorgas, das mit Wasser zu Chlorsäure reagiert.
Zur Herstellung von Chlorsäure kann Kaliumchlorat mit Schwefelsäure umgesetzt und das erhaltene Gemisch anschließend destilliert werden.
Die Synthese von Chlorsäure erfordert aufgrund der Gefahr heftiger Reaktionen und der korrosiven Natur der beteiligten Säuren einen sorgfältigen Umgang mit den Reagenzien. Es ist wichtig, die richtigen Sicherheitsprotokolle zu befolgen und Materialien in einem gut belüfteten Bereich unter Verwendung geeigneter Schutzausrüstung zu handhaben.
Verwendung von Chlorsäure (HClO3)
Chlorsäure (HClO3) findet aufgrund ihrer starken oxidierenden Eigenschaften zahlreiche Anwendungen in verschiedenen Branchen. Einige seiner Verwendungsmöglichkeiten sind:
- Herstellung anderer Chemikalien: Chlorsäure dient als Zwischenprodukt bei der Herstellung anderer Chemikalien, einschließlich Perchlorsäure, Chloraten und Perchloraten.
- Bleichmittel: Die Zellstoff- und Papierindustrie verwendet Chlorsäure als Bleichmittel.
- Desinfektionsmittel: Chlorsäure dient in der Lebensmittel- und Getränkeindustrie als Desinfektionsmittel zur Desinfektion von Geräten und Oberflächen.
- Ätzmittel: Die Halbleiterindustrie verwendet Chlorsäure als Ätzmittel, um unerwünschte Materialschichten von Halbleiterwafern zu entfernen.
- Laborreagenz: Chlorsäure wird als Laborreagenz in der analytischen Chemie und der organischen Synthese verwendet.
- Oxidationsmittel: Chlorsäure wird als Oxidationsmittel in Reaktionen der organischen Chemie verwendet.
- Raketentreibstoff: Chlorsäure dient als Oxidationsmittel in Raketentreibstoffen.
- Wasseraufbereitung: Chlorsäure wird bei der Wasseraufbereitung verwendet, um das Wachstum von Algen und Bakterien zu kontrollieren.
Fragen:
F: Ist Chlorsäure eine starke Säure?
A: Ja, Chlorsäure (HClO3) ist eine starke Säure.
F: Welche Formel stellt Chlorsäure dar?
A: Die Formel für Chlorsäure ist HClO3.
F: Erklären Sie, warum HCl Salzsäure und HClO3 Chlorsäure ist?
A: Die Namen binärer Säuren (Verbindungen, die nur zwei Elemente enthalten) leiten sich normalerweise vom Namen des Anions ab, mit dem Suffix -ic für das häufigste Anion und -ous für das am wenigsten häufige. Im Fall von HCl ist das Anion Chlorid (Cl-), daher wird die Säure Salzsäure genannt. Im Fall von HClO3 ist das Anion Chlorat (ClO3-), daher wird die Säure Chlorsäure genannt.
F: Wie lautet die Formel für Chlorsäure?
A: Die Formel für Chlorsäure ist HClO3.
F: Ist Chlorsäure ionisch oder molekular?
A: Chlorsäure ist molekular, weil sie aus kovalent gebundenen Wasserstoff-, Chlor- und Sauerstoffatomen besteht.
