Ethanol oder C2H6O ist ein farbloser, brennbarer Alkohol, der aus pflanzlichen Materialien gewonnen wird und häufig als Biokraftstoff oder Lösungsmittel verwendet wird. Es ist auch eine häufige Zutat in alkoholischen Getränken.
| IUPAC-Name | Ethanol |
| Molekularformel | C2H6O |
| CAS-Nummer | 64-17-5 |
| Synonyme | Ethylalkohol, Getreidealkohol, EtOH, Alkohol |
| InChI | InChI=1S/C2H6O/c1-2-3/h3H,2H2,1H3 |
Eigenschaften von Ethanol
Lewis-Struktur C2H6O
Die Lewis-Struktur für C2H6O (auch als Ethanol bekannt) kann wie folgt dargestellt werden:
HH
| |
HCCOH
| |
HH
In dieser Struktur sind die beiden Kohlenstoffatome durch eine einzige kovalente Bindung miteinander verbunden. Jedes Kohlenstoffatom ist außerdem an drei Wasserstoffatome gebunden und ein Kohlenstoffatom ist an ein Sauerstoffatom gebunden. Das Sauerstoffatom ist durch eine einzelne kovalente Bindung mit dem Kohlenstoffatom verbunden und verfügt über zwei Paare freier Elektronen.
Diese Struktur erfüllt die Oktettregel, die besagt, dass jedes Atom im Molekül acht Elektronen in seiner Valenzschale haben muss. Kohlenstoffatome haben in ihrer Valenzschale vier Elektronen, während Wasserstoffatome jeweils ein Elektron haben. Das Sauerstoffatom hat sechs Valenzelektronen und erfüllt mit zwei zusätzlichen freien Elektronenpaaren die Oktettregel.
C2H6O Molmasse
Ethanol hat eine Molmasse von etwa 46,07 g/mol. Die Molmasse eines Stoffes ist definiert als die Masse eines Mols dieses Stoffes. Im Fall von Ethanol enthält ein Mol Ethanol etwa 46,07 Gramm der Substanz. Die Molmasse ist ein nützlicher Parameter für chemische Berechnungen, da sie die Umrechnung zwischen Masse und Mol einer Substanz ermöglicht.
Siedepunkt von Ethanol
Ethanol hat bei Normaldruck einen Siedepunkt von etwa 78,5 °C (173,3 °F). Dieser relativ niedrige Siedepunkt erleichtert die Verdampfung von Ethanol, was in vielen industriellen Prozessen nützlich ist. Beispielsweise wird Ethanol häufig als Lösungsmittel bei der Herstellung von Arzneimitteln, Parfüms und anderen Chemikalien verwendet.
Schmelzpunkt von Ethanol
Ethanol hat einen Schmelzpunkt von etwa -114,1 °C (-173,4 °F). Dieser niedrige Schmelzpunkt macht Ethanol bei Raumtemperatur flüssig, weshalb es häufig in flüssiger Form als Lösungsmittel oder Kraftstoff verwendet wird. Der Schmelzpunkt von Ethanol ist niedriger als der von Wasser, sodass Ethanol als Frostschutzmittel in Automobilkühlsystemen verwendet werden kann.
Ethanoldichte g/ml
Die Dichte von Ethanol beträgt bei Standardtemperatur und -druck etwa 0,789 g/ml. Das bedeutet, dass ein Milliliter Ethanol 0,789 Gramm wiegt. Die Dichte von Ethanol ist geringer als die von Wasser, das bei Standardtemperatur und -druck eine Dichte von 1 g/ml aufweist. Das bedeutet, dass das Ethanol auf der Wasseroberfläche schwimmt.
Molekulargewicht von Ethanol
Das Molekulargewicht von Ethanol beträgt etwa 46,07 g/mol. Das Molekulargewicht ist die Summe der Atomgewichte aller Atome in einem Molekül. Im Fall von Ethanol enthält es zwei Kohlenstoffatome, sechs Wasserstoffatome und ein Sauerstoffatom. Das Molekulargewicht wird verwendet, um die Anzahl der Mol einer Substanz in einer bestimmten Masse der Substanz zu berechnen.
Struktur von Ethanol
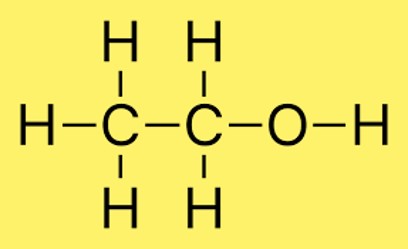
In der Struktur von Ethanol verbinden sich zwei Kohlenstoffatome über eine Einfachbindung und drei Wasserstoffatome an jedes Kohlenstoffatom. Zusätzlich ist an das Sauerstoffatom ein Wasserstoffatom gebunden. Die Anordnung der Atome im Molekül wird üblicherweise durch CH3CH2OH dargestellt.
Ethanol-Formel
Die chemische Formel für Ethanol lautet C2H6O. Diese Formel zeigt die Anzahl und Art der Atome im Molekül. Mit der Formel kann das Molekulargewicht von Ethanol sowie die Anzahl der Mol Ethanol in einer bestimmten Masse der Substanz berechnet werden. Die Formel eignet sich auch zur Vorhersage des chemischen Verhaltens von Ethanol bei Reaktionen mit anderen Chemikalien.
| Aussehen | Farblose Flüssigkeit |
| Spezifisches Gewicht | 0,789 |
| Farbe | Farblos |
| Geruch | Charakteristischer Geruch |
| Molmasse | 46,07 g/Mol |
| Dichte | 0,789 g/ml |
| Fusionspunkt | -114,1 °C (-173,4 °F) |
| Siedepunkt | 78,5 °C (173,3 °F) bei Standarddruck |
| Blitzpunkt | 13°C (55°F) |
| Löslichkeit in Wasser | Mischbar |
| Löslichkeit | Löslich in polaren und unpolaren Lösungsmitteln |
| Dampfdruck | 44,6 kPa bei 20°C |
| Wasserdampfdichte | 1,59 (Luft = 1) |
| pKa | 15,9 bis 25°C |
| pH-Wert | 7 (neutral) |
Sicherheit und Gefahren von Ethanol
Ethanol ist eine brennbare Flüssigkeit und kann bei unsachgemäßer Handhabung eine Brand- und Explosionsgefahr darstellen. Auch Ethanoldämpfe können sich leicht entzünden und eine ernsthafte Brandgefahr darstellen. Auch Ethanol kann bei Einnahme gesundheitsschädlich sein und übermäßiger Konsum kann zu einer Alkoholvergiftung führen. Das Einatmen großer Mengen Ethanoldampf kann Schwindel, Kopfschmerzen und Übelkeit verursachen. Auch eine längere Einwirkung von Ethanol kann zu Hautreizungen und Austrocknung führen. Ethanol sollte an einem kühlen, gut belüfteten Ort fern von Zündquellen und unverträglichen Substanzen gelagert werden. Beim Umgang mit Ethanol sollte geeignete Schutzausrüstung wie Handschuhe und Schutzbrille getragen werden.
| Gefahrensymbole | F, Xi, Flam. Liq. 2 |
| Sicherheitsbeschreibung | Von Hitze, Funken, offenen Flammen und heißen Oberflächen fernhalten. Rauchen verboten. Explosionsgeschützte Elektro-, Lüftungs- und Beleuchtungsgeräte verwenden. Vermeiden Sie das Einatmen von Dämpfen. Schutzhandschuhe und Schutzbrille tragen. Im Brandfall: Zum Löschen trockenes Löschpulver, CO2, Wassersprühstrahl oder Schaum verwenden. Inhalt/Behälter gemäß den lokalen/regionalen/nationalen/internationalen Vorschriften entsorgen. |
| AN-Kennungen | UN1170 |
| HS-Code | 2207.10.00 |
| Gefahrenklasse | 3 |
| Verpackungsgruppe | II |
| Toxizität | Ethanol kann giftig sein, wenn es in großen Mengen eingenommen oder eingeatmet wird. Längerer Kontakt kann außerdem zu Reizungen und Austrocknung der Haut führen. Chronische Einnahme kann zu Alkoholismus und anderen Gesundheitsproblemen führen. |
Methoden der Ethanolsynthese
Ethanol kann durch verschiedene Methoden synthetisiert werden, darunter Fermentation, direkte Ethylenhydratisierung und Biomasseumwandlung.
Die Fermentation ist die gebräuchlichste Methode zur Herstellung von Ethanol und beinhaltet die Umwandlung von Zucker und anderen Kohlenhydraten in Ethanol durch Mikroorganismen wie Hefe. Mit diesem Verfahren wird Ethanol aus Feldfrüchten wie Mais, Gerste und Zuckerrohr sowie aus Abfallstoffen wie Lebensmittelabfällen und landwirtschaftlichen Reststoffen hergestellt.
Die direkte Hydratation von Ethylen ist eine weitere Methode zur Herstellung von Ethanol. Bei diesem Prozess reagiert Ethylen mit Wasser in Gegenwart eines Katalysators wie Phosphorsäure zu Ethanol. Diese Methode wird häufig in industriellen Umgebungen eingesetzt und ist effizienter als die Fermentation.
Die Umwandlung von Biomasse ist eine weitere Methode zur Herstellung von Ethanol und beinhaltet die Umwandlung von Pflanzenmaterialien wie Holzspänen, Gräsern und landwirtschaftlichen Rückständen in Ethanol. Der Prozess beinhaltet den Abbau von Zellulose und Hemizellulose im Pflanzenmaterial in einfache Zucker, die zu Ethanol fermentiert werden können.
Andere Methoden zur Herstellung von Ethanol umfassen die katalytische Kohlendioxidumwandlung und die elektrochemische Kohlendioxidreduktion.
Jede dieser Methoden hat ihre Vor- und Nachteile, und die Wahl der Methode hängt von Faktoren wie der Verfügbarkeit von Rohstoffen, Kosten und Wirksamkeit ab. Aufgrund ihrer Kosteneffizienz und Zuverlässigkeit ist die Fermentation nach wie vor die am weitesten verbreitete Methode zur Ethanolherstellung.
Verwendungsmöglichkeiten von Ethanol
Ethanol hat eine breite Palette industrieller, kommerzieller und privater Verwendungszwecke. Zu den häufigsten Verwendungszwecken gehören:
- Ethanol erhöht die Oktanzahl und reduziert die Emissionen, wenn es als Benzinzusatz verwendet wird.
- Ethanol ist ein vielseitiges Lösungsmittel, das häufig bei der Herstellung von pharmazeutischen, kosmetischen und Körperpflegeprodukten verwendet wird.
- Alkoholische Getränke wie Bier, Wein und Spirituosen enthalten Ethanol als Wirkstoff.
- Händedesinfektionsmittel, Oberflächenreiniger und andere Reinigungsprodukte verwenden Ethanol als wirksames Desinfektionsmittel.
- Ethanol wird als Lösungsmittel bei der Extraktion ätherischer Öle, Aromen und anderer natürlicher Verbindungen verwendet.
- Hersteller verwenden Ethanol als Ausgangsstoff für die Herstellung anderer Chemikalien wie Essigsäure und Ethylen.
- Körperpflegeprodukte wie Parfüme, Lotionen und Haarpflegeprodukte verwenden Ethanol als Konservierungsmittel und Duftstoff.
- Chemische Laboratorien verwenden üblicherweise Ethanol als Lösungsmittel und Reagenz.
- Automobil- und andere Kühlsysteme können Ethanol als Frostschutzmittel verwenden.
Fragen:
Aus wie vielen Atomen besteht ein Ethanolmolekül (C2H6O)?
Ein Ethanolmolekül (C2H6O) besteht aus 9 Atomen: 2 Kohlenstoffatomen, 6 Wasserstoffatomen und 1 Sauerstoffatom.
