Aluminiumsulfat ist ein anorganisches Salz, das üblicherweise als Koagulierungsmittel bei Wasseraufbereitungsprozessen und als Flockungsmittel bei der Flüssigkeitsreinigung verwendet wird.
| IUPAC-Name | Aluminiumsulfat |
| Molekularformel | Al2(SO4)3 |
| CAS-Nummer | 10043-01-3 |
| Synonyme | Aluminiumsulfat, Diaaluminiumsulfat, Kuchenalaun, Papierfabrikalaun, Filteralaun |
| InChI | InChI=1S/2Al.3H2O.14H2SO4/c;;31-5(2,3)4/h;;(H2,1,2,3,4)/q2+3;/p-3 |
Aluminiumsulfat-Formel
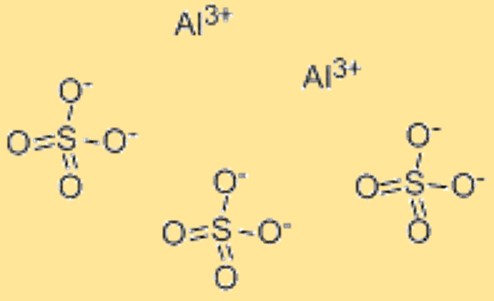
Die chemische Formel für Aluminiumsulfat lautet Al2(SO4)3. Diese Formel stellt das Verhältnis der Atome in Aluminiumsulfat dar und wird verwendet, um die Zusammensetzung der Verbindung anzugeben. Die Formel kann auch für chemische Berechnungen verwendet werden, beispielsweise zur Bestimmung der Molmasse oder der Anzahl der Mol Aluminiumsulfat in einer bestimmten Probe. Die chemische Formel für Aluminiumsulfat bietet eine praktische Möglichkeit, die Zusammensetzung des Materials darzustellen und ist in der wissenschaftlichen Gemeinschaft weithin anerkannt. Darüber hinaus kann die Formel verwendet werden, um die chemischen und physikalischen Eigenschaften von Aluminiumsulfat vorherzusagen, beispielsweise seine Löslichkeit in Wasser, seine Reaktivität mit anderen Verbindungen und seine Stabilität unter verschiedenen Bedingungen.
Molmasse von Aluminiumsulfat
Die Molmasse von Aluminiumsulfat beträgt 342,15 g/mol. Dieser Wert ist für verschiedene chemische und physikalische Berechnungen wichtig, einschließlich der Bestimmung molarer Konzentrationen, der Stöchiometrie von Reaktionen und des idealen Gasgesetzes. Die Molmasse wird durch Addition der Atomgewichte aller Atome in der chemischen Formel für Aluminiumsulfat, also Al2(SO4)3, berechnet. Die Molmasse kann auch verwendet werden, um die Masse einer bestimmten Aluminiumsulfatprobe in die Anzahl der Mol umzurechnen.
Siedepunkt von Aluminiumsulfat
Der Siedepunkt von Aluminiumsulfat ist nicht genau definiert, da es sich vor dem Sieden zersetzt. Aluminiumsulfat ist ein hydratisiertes Salz, das beim Erhitzen sein Hydratwasser verliert und in Aluminiumoxid und Schwefelsäure zerfällt. Die Zersetzungstemperatur kann je nach Hydratationsgrad zwischen 120 °C und 140 °C variieren. Auch das Vorhandensein von Verunreinigungen in der Probe kann die Zersetzungstemperatur beeinflussen.
Schmelzpunkt von Aluminiumsulfat
Der Schmelzpunkt von Aluminiumsulfat liegt bei etwa 1200 °C. Diese hohe Temperatur ist auf die starken Ionenbindungen zwischen Aluminium- und Schwefelionen zurückzuführen. Aluminiumsulfat ist bei Raumtemperatur ein kristalliner Feststoff und weist eine wohldefinierte Kristallstruktur auf, die zu seinem hohen Schmelzpunkt beiträgt. Der Schmelzpunkt von Aluminiumsulfat ist wichtig für die Bestimmung der Verarbeitungsbedingungen, die für die Synthese und Reinigung des Materials erforderlich sind.
Dichte von Aluminiumsulfat g/ml
Die Dichte von Aluminiumsulfat beträgt 1,8 bis 2,0 g/ml. Dieser Wert kann je nach Hydratationsgrad und Vorhandensein von Verunreinigungen in der Probe variieren. Die Dichte von Aluminiumsulfat ist eine wichtige physikalische Eigenschaft, die zur Berechnung des Volumens einer bestimmten Masse des Materials verwendet werden kann. Die Dichte von Aluminiumsulfat ist auch bei der Bestimmung der Konzentration einer Lösung nützlich, da sie es ermöglicht, die Masse des gelösten Stoffes pro Volumeneinheit Lösungsmittel zu berechnen.
Molekulargewicht von Aluminiumsulfat
Wir bestimmen, dass das Molekulargewicht von Aluminiumsulfat 342,15 g/mol beträgt, indem wir die Atomgewichte aller Atome in seiner chemischen Formel Al2(SO4)3 addieren. Dieser Wert dient sowohl als Molekulargewicht als auch als Molmasse und spielt eine entscheidende Rolle bei chemischen Berechnungen, einschließlich der Bestimmung von Molkonzentrationen und der Reaktionsstöchiometrie.
Struktur aus Aluminiumsulfat
Aluminiumsulfat hat eine Kristallstruktur bestehend aus Aluminiumkationen (Al3+) und Sulfatanionen (SO4^2-). Die Aluminiumkationen koordinieren mit sechs Sulfatanionen in einer engen hexagonalen Anordnung, die durch starke Ionenbindungen zusammengehalten werden. Die Kristallstruktur von Aluminiumsulfat beeinflusst seine physikalischen Eigenschaften wie seinen Schmelzpunkt und seine Löslichkeit.
| Aussehen | Kristalliner Feststoff |
| Spezifisches Gewicht | 1,8 bis 2,0 g/ml |
| Farbe | Weiß |
| Geruch | Geruchlos |
| Molmasse | 342,15 g/Mol |
| Dichte | 1,8 bis 2,0 g/ml |
| Fusionspunkt | 770°C |
| Siedepunkt | Zerfällt vor dem Kochen |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | In Wasser löslich |
| Löslichkeit | In Wasser löslich |
| Dampfdruck | Nicht genau definiert |
| Wasserdampfdichte | Nicht genau definiert |
| pKa | Nicht genau definiert |
| pH-Wert | Neutral |
Sicherheit und Gefahren von Aluminiumsulfat
Aluminiumsulfat ist ein gefährlicher Stoff, der mit Vorsicht gehandhabt werden muss. Das Einatmen des Staubes kann zu Reizungen der Atemwege und Husten führen. Bei Kontakt mit der Haut oder den Augen kann es zu Rötungen, Juckreiz und Brennen kommen. Die Einnahme von Aluminiumsulfat kann zu Magen-Darm-Reizungen wie Übelkeit, Erbrechen und Durchfall führen. Wenn es in großen Mengen eingenommen wird, kann es zu schwerwiegenderen Gesundheitsproblemen wie einer Depression des Zentralnervensystems und Nierenschäden führen. Daher ist es wichtig, beim Umgang mit Aluminiumsulfat persönliche Schutzausrüstung wie Handschuhe und Schutzbrille zu tragen. Darüber hinaus sollte der Arbeitsbereich gut belüftet sein, um das Risiko des Einatmens von Staub zu verringern. Bei Haut- oder Augenkontakt sollte die betroffene Stelle mindestens 15 Minuten lang mit reichlich Wasser gespült und sofort ein Arzt aufgesucht werden.
| Gefahrensymbole | Xi – Irritierend |
| Sicherheitsbeschreibung | S24/25 – Kontakt mit Haut und Augen vermeiden |
| AN-Kennungen | UN3077 – Umweltgefährdung |
| HS-Code | 2833.30.00 |
| Gefahrenklasse | 8 – Ätzender Stoff |
| Verpackungsgruppe | III |
| Toxizität | Geringe bis mäßige Toxizität bei Verschlucken, Einatmen oder Kontakt mit Haut oder Augen |
Methoden zur Synthese von Aluminiumsulfat
Aluminiumsulfat kann durch verschiedene Methoden synthetisiert werden, einschließlich Fällung und Reaktion mit Schwefelsäure.
Eine Synthesemethode ist die Fällungsmethode, bei der eine Lösung von Aluminiumsalzen mit Schwefelsäure vermischt wird. Diese Reaktion führt zur Bildung von Aluminiumsulfat, das in fester Form aus der Lösung ausfällt. Der Feststoff kann dann filtriert, gewaschen und getrocknet werden, um reines Aluminiumsulfat zu erhalten.
Eine weitere Synthesemethode ist die Reaktion, bei der Aluminiumhydroxid oder Aluminiumoxid mit Schwefelsäure vermischt wird. Diese Reaktion führt zur Bildung von Aluminiumsulfat und Wasser. Anschließend kann das Produkt durch Waschen und Trocknen gereinigt werden.
Bei beiden Methoden kann die Reinheit des Endprodukts durch die Verwendung hochreiner Ausgangsmaterialien und eine sorgfältige Steuerung der Reaktionsbedingungen verbessert werden. Die Reinheit von Aluminiumsulfat kann durch Analyse seiner physikalischen und chemischen Eigenschaften wie Molmasse, Schmelzpunkt und Wasserlöslichkeit überprüft werden.
Insgesamt handelt es sich bei der Synthese von Aluminiumsulfat um einen relativ einfachen Prozess, der je nach gewünschtem Produktionsmaßstab im Labor oder im industriellen Umfeld durchgeführt werden kann. Die Wahl der Synthesemethode hängt von der Verfügbarkeit der Rohstoffe, der gewünschten Reinheit des Produkts und dem gewünschten Produktionsumfang ab.
Verwendung von Aluminiumsulfat
Die Industrie nutzt Aluminiumsulfat aufgrund seiner Vielseitigkeit in verschiedenen Anwendungen wie der Wasseraufbereitung, der Papierproduktion und der Landwirtschaft. Bei der Wasseraufbereitung wirkt der Stoff als Gerinnungsmittel und reinigt das Trinkwasser, indem er bewirkt, dass sich Verunreinigungen ansammeln und größere Partikel bilden, die leicht gefiltert werden können. Die Papierindustrie verwendet Aluminiumsulfat als Füllstoff und Bindemittel, um die Festigkeit und den Glanz des Papiers zu verbessern und den pH-Wert im Zellstoff zu regulieren. In der Landwirtschaft senkt Aluminiumsulfat den pH-Wert des Bodens und erhöht den Säuregehalt, wodurch Pflanzen mit wichtigen Nährstoffen wie Schwefel und Aluminium versorgt werden. Aluminiumsulfat wird auch für andere Zwecke verwendet, unter anderem zum Gerben von Leder, zum Feuerfestmachen von Textilien und als Flockungsmittel bei der Abwasserbehandlung. Daher spielt Aluminiumsulfat im modernen Leben eine wichtige Rolle, da es in verschiedenen Branchen verschiedene Zwecke erfüllt.
Fragen:
Wie lautet die Formel für Aluminiumsulfat?
Die chemische Formel für Aluminiumsulfat lautet Al2(SO4)3.
Ist Aluminiumsulfat löslich?
Ja, Aluminiumsulfat ist wasserlöslich. Es löst sich in Wasser auf und bildet eine Lösung aus Aluminium-, Sulfat- und Hydroxidionen. Die Löslichkeit von Aluminiumsulfat in Wasser ist temperaturabhängig, was bedeutet, dass es bei höheren Temperaturen löslicher und bei niedrigeren Temperaturen weniger löslich ist. Bei Raumtemperatur ist Aluminiumsulfat leicht wasserlöslich, mit einer Löslichkeit von etwa 20 Gramm pro 100 Milliliter Wasser.
