2 Butanon, auch bekannt als Methylethylketon oder MEK, ist eine farblose, brennbare Flüssigkeit mit einem süßen, fruchtigen Geruch. Es wird häufig als Lösungsmittel in verschiedenen Industrie- und Haushaltsanwendungen verwendet.
| IUPAC-Name | 2-Butanon |
| Molekularformel | C4H8O |
| CAS-Nummer | 78-93-3 |
| Synonyme | Methylethylketon (MEK), Butan-2-on, 2-Butanon, 3-Oxobutan-2-on |
| InChI | InChI=1S/C4H8O/c1-3-4-5-2/h3-4H,1-2H3 |
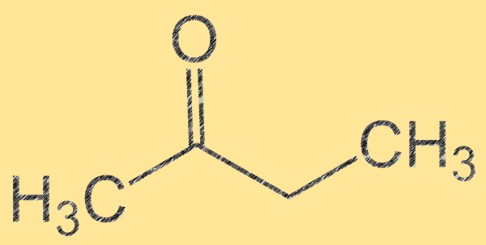
Struktur von Butanon
Butanon hat die Summenformel C4H8O und seine Molekülstruktur kann als CH3C(O)CH2CH3 dargestellt werden. Es ist eine farblose, brennbare Flüssigkeit mit einem süßen, fruchtigen Geruch. Butanon ist ein Keton, das heißt, es enthält eine Carbonylgruppe (C=O), die an ein Kohlenstoffatom gebunden ist. Diese Carbonylgruppe macht Butanon zu einem wichtigen Zwischenprodukt bei der Synthese verschiedener organischer Verbindungen.
Molmasse von 2-Butanon
Butanon, auch Methylethylketon (MEK) genannt, hat eine Molmasse von 72,11 g/mol. Dies ist die Stoffmenge in einer bestimmten Butanonprobe, ausgedrückt in Gramm pro Mol. Die Molmasse ist eine wichtige Eigenschaft von Butanon, die in verschiedenen Berechnungen und Experimenten in der Chemie verwendet wird, beispielsweise um die Masse eines Stoffes zu bestimmen, die erforderlich ist, um mit einem anderen Stoff in einem bestimmten Molverhältnis zu reagieren. Die Molmasse von Butanon kann auch zur Umrechnung seiner Masse in Mol verwendet werden, was in vielen Anwendungen nützlich ist, einschließlich chemischer Reaktionen, chemischer Synthese und analytischer Chemie.
Siedepunkt von MEK
Der Siedepunkt von MEK beträgt 80,6 °C (176,5 °F). Dies ist die Temperatur, bei der MEK von flüssig in gasförmig übergeht. Der Siedepunkt ist eine wichtige Eigenschaft von MEK, da er seine Fähigkeit zur Verdampfung und Dampfbildung beeinflusst. Beispielsweise wird MEK in einigen Anwendungen als Lösungsmittel verwendet und es ist wünschenswert, dass es schnell verdunstet, damit der gelöste Stoff entfernt werden kann. Bei anderen Anwendungen ist es wünschenswert, dass MEK in seiner flüssigen Form verbleibt, damit es als Lösungsmittel für Reaktionen verwendet werden kann, die bei oder unterhalb seines Siedepunkts durchgeführt werden.
MEK Schmelzpunkt
Der Schmelzpunkt von MEK beträgt -93,9 °C (-136,0 °F). Dies ist die Temperatur, bei der MEK vom festen in den flüssigen Zustand übergeht. Der Schmelzpunkt ist eine wichtige Eigenschaft von MEK, da er seine Fähigkeit beeinflusst, als Lösungsmittel für feste Substanzen verwendet zu werden. Beispielsweise kann MEK als Lösungsmittel für bestimmte Feststoffe verwendet werden, deren Schmelzpunkt niedriger als sein eigener Schmelzpunkt liegt, wie zum Beispiel Fette, Wachse und Harze.
MEK-Dichte g/ml
Die Dichte von MEK beträgt 0,80 g/ml. Dies ist die Masse pro Volumeneinheit MEK und eine wichtige Eigenschaft, die in vielen Anwendungen verwendet wird, einschließlich der Berechnung der Menge an MEK, die für ein bestimmtes Volumen erforderlich ist. Die Dichte von MEK wird auch zur Berechnung seines Molvolumens verwendet, das das Volumen ist, das von einem Mol MEK eingenommen wird. Diese Informationen sind bei verschiedenen Experimenten nützlich, einschließlich der Bestimmung der Molmasse einer Substanz.
MEK-Molekulargewicht
Das Molekulargewicht von MEK beträgt 72,11 g/mol. Es ist die Summe der Atomgewichte der Atome in einem MEK-Molekül und eine wichtige Eigenschaft, die in vielen Anwendungen verwendet wird, einschließlich der Berechnung der Molmasse einer Substanz. Das Molekulargewicht von MEK kann zur Umrechnung seiner Masse in Mol verwendet werden, was in vielen Anwendungen nützlich ist, einschließlich chemischer Reaktionen, chemischer Synthese und analytischer Chemie.
MEK-Formel
Die chemische Formel für MEK lautet C4H8O. Diese Formel stellt relative Proportionen dar.
| Aussehen | Farblose Flüssigkeit |
| Spezifisches Gewicht | 0,79 – 0,80 |
| Farbe | Farblos |
| Geruch | Süß, fruchtig |
| Molmasse | 72,11 g/Mol |
| Dichte | 0,79 – 0,80 g/ml |
| Fusionspunkt | -93,9 °C (-136,0 °F) |
| Siedepunkt | 80,6 °C (176,5 °F) |
| Blitzpunkt | 12°C (53,6°F) |
| Löslichkeit in Wasser | Löslich |
| Löslichkeit | Löslich in den meisten organischen Lösungsmitteln |
| Dampfdruck | 38 mmHg (20°C) |
| Wasserdampfdichte | 2,3 (Luft = 1) |
| pKa | 20.2 |
| pH-Wert | 7 (neutral) |
Hinweis: Die in dieser Tabelle angegebenen Werte sind Näherungswerte und können je nach Quelle und Messbedingungen leicht variieren.
Sicherheit und Gefahren von Butanon
Butanon, auch Methylethylketon genannt, ist eine brennbare und flüchtige Flüssigkeit, die bei unsachgemäßer Handhabung Reizungen der Haut, Augen und Atemwege verursachen kann. Das Einatmen hoher Butanonkonzentrationen kann Kopfschmerzen, Schwindel, Übelkeit und Bewusstlosigkeit verursachen. Eine längere Exposition gegenüber niedrigen Butanonkonzentrationen kann zu Nieren- und Leberschäden führen. Außerdem ist es leicht entflammbar und kann sich leicht entzünden, was eine Brandgefahr darstellt. Bei der Verwendung von Butanon ist es wichtig, in einem gut belüfteten Bereich zu arbeiten, Schutzkleidung und Schutzbrille zu tragen und Hautkontakt zu vermeiden. Bei Haut- oder Augenkontakt sofort mit Wasser abspülen und ggf. einen Arzt aufsuchen. Bei Verschlucken kein Erbrechen herbeiführen und sofort einen Arzt aufsuchen. Butanon sollte an einem kühlen, trockenen und gut belüfteten Ort, entfernt von Wärmequellen und Flammen, gelagert werden.
| Gefahrensymbole | Entzündbare Flüssigkeit, Reizend |
| Sicherheitsbeschreibung | S2 – Außerhalb der Reichweite von Kindern aufbewahren<br>S16 – Von Zündquellen fernhalten<br>S24/25 – Kontakt mit Haut und Augen vermeiden<br>S26 – Bei Augenkontakt sofort mit viel Wasser spülen und ärztlichen Rat einholen |
| AN-Kennungen | UN1090 |
| HS-Code | 29141100 |
| Gefahrenklasse | 3 (Brennbare Flüssigkeit) |
| Verpackungsgruppe | II |
| Toxizität | LD50 (oral, Ratte) – 4.220 mg/kg |
Butanon-Synthesemethoden
Butanon kann auf verschiedene Weise synthetisiert werden, darunter die direkte Oxidation von 2-Butanol und die Aldolkondensation von Aceton und 2-Propanol.
Bei der direkten Oxidationsmethode wird 2-Butanol mit einem Oxidationsmittel wie Chromsäure, Wasserstoffperoxid oder einer Mischung aus Salpetersäure und Schwefelsäure umgesetzt. Die Reaktion findet im sauren Milieu statt und das entstehende Methylethylketon wird durch Destillation vom Reaktionsgemisch abgetrennt.
Bei der Aldolkondensationsmethode wird Aceton mit 2-Propanol in Gegenwart einer starken Base wie Natriumhydroxid oder Kaliumhydroxid umgesetzt. Bei der Reaktion entsteht ein Gemisch aus Methylethylketon und anderen Nebenprodukten, die durch Destillation abgetrennt werden.
Eine andere Synthesemethode beinhaltet die Reaktion von Aceton mit Formaldehyd in Gegenwart eines Katalysators wie Schwefelsäure oder p-Toluolsulfonsäure. Bei dieser Reaktion entsteht eine Mischung aus Methylethylketon, Formaldehyd und anderen Nebenprodukten, die durch Destillation abgetrennt werden.
Insgesamt erfordert die Synthese von Methylethylketon eine sorgfältige Kontrolle der Reaktionsbedingungen, um die Produktion eines qualitativ hochwertigen Produkts mit minimalen Nebenprodukten sicherzustellen. Bei der Arbeit mit Chemikalien und Reaktionen, die an der Synthese von Methylethylketon beteiligt sind, ist es wichtig, die entsprechenden Sicherheitsvorkehrungen zu beachten.
Verwendung von Butanon
Butanon, auch Methylethylketon genannt, hat aufgrund seiner Lösungsmittelfähigkeit, Flüchtigkeit und seines niedrigen Siedepunkts ein breites Spektrum an industriellen Anwendungen. Zu den häufigsten Anwendungen von Butanon gehören:
- Lösungsmittel: Methylethylketon wird als Lösungsmittel für verschiedene Stoffe wie Harze, Klebstoffe, Tinten, Abbeizmittel, Druckfarben, Nitrozelluloselacke und synthetische Kautschuke verwendet.
- Reinigungsmittel: In der Elektronikindustrie wird es als Reinigungsmittel eingesetzt, um Metallteile und Oberflächen von Fett, Öl und anderen Verunreinigungen zu reinigen.
- Pharmazeutika: In der Pharmaindustrie wird Methylethylketon als Lösungsmittel bei der Herstellung von Impfstoffen, Antibiotika und anderen Arzneimitteln verwendet.
- Beschichtungen: Auch Beschichtungen für Holz, Papier und andere Materialien verwenden bei ihrer Herstellung sowie bei der Herstellung von Lacken, Lacken und anderen Schutzbeschichtungen Methylethylketon als Lösungsmittel.
- Parfüme: Die Kosmetik- und Lebensmittelindustrie verwendet Methylethylketon als Lösungsmittel für Parfüme und Aromen.
- Klebstoffe: Auch Kleb- und Dichtstoffe verwenden bei ihrer Herstellung Methylethylketon als Lösungsmittel.
Zusätzlich zu seiner industriellen Verwendung wurde Methylethylketon auch auf sein Potenzial als Kraftstoff untersucht. Sein hoher Energiegehalt und seine im Vergleich zu anderen Kraftstoffen geringe Toxizität machen ihn zu einer vielversprechenden alternativen Energiequelle.
Fragen:
Was wird die folgende Reaktion hervorrufen? 2-Butanon + H2/Ni-Katalysator
Die Reaktion von 2-Butanon mit Wasserstoffgas an einem Nickelkatalysator wird als Hydrierungsreaktion bezeichnet. Diese Reaktion ergibt das folgende Produkt:
2-Butanon + H2 -> 2-Butanol
Die Reduktion der Doppelbindung zwischen Kohlenstoff- und Sauerstoffatomen in der Ketongruppe von 2-Butanon führt zur Bildung von 2-Butanol durch Aktivierung von Wasserstoffgas durch einen Nickelkatalysator. Die chemische Industrie nutzt diese Reaktion üblicherweise zur Herstellung von 2-Butanol, einem wertvollen Lösungsmittel und Rohstoff für andere chemische Produktionen. Für eine effiziente und selektive Hydrierung von 2-Butanon zu 2-Butanol ist eine sorgfältige Kontrolle von Temperatur, Druck und Katalysatortyp erforderlich.
Ist 2-Butanon ein Keton?
Die organische Chemie charakterisiert 2-Butanon, auch bekannt als Methylethylketon, als einen Ketontyp mit einer Carbonylgruppe (C=O), die an ein Kohlenstoffatom innerhalb einer Kohlenwasserstoffkette gebunden ist. Die Carbonylgruppe von 2-Butanon befindet sich zwischen zwei Kohlenstoffatomen, daher die Bezeichnung „Methylethylketon“.
Was ist das Infrarotspektrum von 2-Butanon?
Das IR-Spektrum (Infrarot) von 2-Butanon (auch bekannt als Methylethylketon) kann wichtige Informationen über seine Molekülstruktur und funktionelle Gruppen liefern. Das IR-Spektrum von 2-Butanon zeigt im Allgemeinen die folgenden Hauptabsorptionsbanden:
- Carbonyl-Streckung: Diese Bande erscheint als scharfer Peak zwischen 1700 und 1700 cm^-1 und ist charakteristisch für die funktionelle C=O-Gruppe des Ketons.
- Alkylstreckung: Die Peaks zwischen 2900 und 3000 cm^-1 entsprechen den Streckschwingungen der CH2- und CH3-Gruppen in 2-Butanon.
- CH-Biegung: Die Peaks zwischen 1400 und 1500 cm^-1 entsprechen den Biegeschwingungen von CH-Bindungen in 2-Butanon.
- COC-Biegung: Der Peak zwischen 1300 und 1400 cm^-1 entspricht den Biegeschwingungen der COC-Gruppe in 2-Butanon.
Es ist wichtig zu beachten, dass das IR-Spektrum von 2-Butanon durch die Probenvorbereitung und die verwendeten Instrumente sowie durch das Vorhandensein von Verunreinigungen oder Verunreinigungen beeinflusst wird.
