4-Ethylphenol oder C8H10O ist eine chemische Verbindung mit einem süßen, würzigen und krautigen Geruch, die in Parfüms, Aromen und als Fungizid in der Landwirtschaft verwendet wird. Es kann auch ein Nebenprodukt des Weinverderbs sein.
| IUPAC-Name | 4-Ethylphenol |
| Molekularformel | C8H10O |
| CAS-Nummer | 104-96-7 |
| Synonyme | p-Ethylphenol, 4-Hydroxyethylbenzol, 4-EHP |
| InChI | InChI=1S/C8H10O/c1-7-3-2-6-4-8(7)5-9/h2-5.9H.6H2.1H3 |
Formel 4-Ethylphenol
Die Formel für 4-Ethylphenol lautet C8H10O. Die Formel gibt die Anzahl und Art der Atome im Molekül an und wird zur Berechnung seiner Molmasse, seines Molekulargewichts und anderer Eigenschaften verwendet.
C8H10O-NMR
Mithilfe der Kernspinresonanzspektroskopie (NMR) können Wissenschaftler die Struktur und Zusammensetzung von Molekülen untersuchen. Durch die Analyse des C8H10O-NMR-Spektrums von 4-Ethylphenol können sie chemische Verschiebungen, Kopplungskonstanten und Peakintensitäten identifizieren, die Informationen über die Struktur und Zusammensetzung des Moleküls liefern.
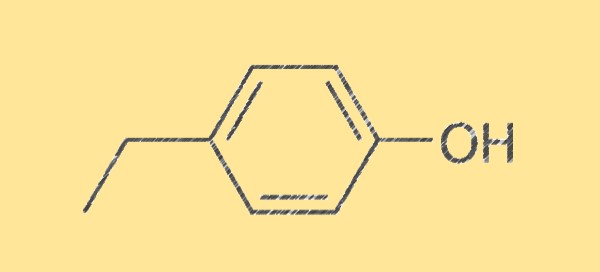
Struktur von 4-Ethylphenol C8H10O
Die Struktur von 4-Ethylphenol wird durch seine Summenformel C8H10O charakterisiert, die aus acht Kohlenstoffatomen, zehn Wasserstoffatomen und einem Sauerstoffatom besteht. Es ist eine farblose Flüssigkeit mit einem süßen, würzigen und krautigen Geruch. Das Molekül ist symmetrisch und hat eine Hydroxylgruppe (-OH), die an ein Kohlenstoffatom gebunden ist, was es zu einem Phenol macht.
Molmasse von 4-Ethylphenol
Die Molmasse von 4-Ethylphenol beträgt 134,17 g/mol. Die Molmasse ist definiert als die Masse einer Substanz, die ein Mol an Einheiten wie Atomen, Molekülen oder Ionen enthält. Sie wird durch Addition der Atommassen aller Elemente im Molekül berechnet. Im Fall von 4-Ethylphenol ergibt sich aus der Summenformel (C8H10O) eine Molmasse von 134,17 g/mol.
Siedepunkt von 4-Ethylphenol
Der Siedepunkt von 4-Ethylphenol liegt bei 218,7°C. Der Siedepunkt eines Stoffes ist die Temperatur, bei der sein Dampfdruck dem Atmosphärendruck entspricht und die Flüssigkeit in Dampf übergeht. Der Siedepunkt von 4-Ethylphenol ist aufgrund der im Molekül vorhandenen intermolekularen Anziehungskräfte relativ hoch.
Schmelzpunkt von 4-Ethylphenol
Der Schmelzpunkt von 4-Ethylphenol beträgt 9,7°C. Der Schmelzpunkt eines Stoffes ist die Temperatur, bei der er vom festen in den flüssigen Zustand übergeht. Der Schmelzpunkt von 4-Ethylphenol ist aufgrund seines geringen Molekulargewichts und des Fehlens starker intermolekularer Kräfte relativ niedrig.
Dichte von 4-Ethylphenol g/ml
Die Dichte von 4-Ethylphenol beträgt 1,02 g/ml. Die Dichte eines Stoffes ist definiert als seine Masse pro Volumeneinheit. Sie wird berechnet, indem man die Masse einer Stoffprobe durch ihr Volumen dividiert. Die Dichte von 4-Ethylphenol ist aufgrund seines geringen Molekulargewichts und des Fehlens starker intermolekularer Kräfte relativ gering.
Molekulargewicht von 4-Ethylphenol
Das Molekulargewicht von 4-Ethylphenol beträgt 134,17 g/mol. Das Molekulargewicht ist dasselbe wie die Molmasse und wird durch Addition der Atommassen aller Elemente im Molekül berechnet. Im Fall von 4-Ethylphenol ergibt sich aus der Summenformel (C8H10O) ein Molekulargewicht von 134,17 g/mol.
| Aussehen | Farblose Flüssigkeit |
| Spezifisches Gewicht | 1,02 g/ml |
| Farbe | Farblos |
| Geruch | Süßer, würziger und kräuteriger Geruch |
| Molmasse | 134,17 g/Mol |
| Dichte | 1,02 g/ml |
| Fusionspunkt | 9,7°C |
| Siedepunkt | 218,7°C |
| Blitzpunkt | 100°C |
| Löslichkeit in Wasser | Löslich |
| Löslichkeit | Löslich in organischen Lösungsmitteln |
| Dampfdruck | 32 mm Hg (20 °C) |
| Wasserdampfdichte | 2,4 (Luft = 1) |
| pKa | 9.5 |
| pH-Wert | Neutral |
Sicherheit und Gefahren von 4-Ethylphenol
Lagern Sie 4-Ethylphenol fern von Wärme- und Zündquellen, da es sich um eine brennbare Flüssigkeit handelt. Direkter Kontakt kann Haut- und Augenreizungen verursachen und das Einatmen der Dämpfe oder Nebel kann zu Reizungen der Atemwege führen. Schützen Sie sich beim Umgang mit 4-Ethylphenol durch das Tragen von Schutzhandschuhen, einer Schutzbrille und einer Atemschutzmaske. Behandeln Sie es sorgfältig und entsorgen Sie es ordnungsgemäß gemäß den örtlichen Vorschriften.
| Gefahrensymbole | Entzündliche Flüssigkeit, reizend |
| Sicherheitsbeschreibung | S2: Außerhalb der Reichweite von Kindern aufbewahren; S24/25: Kontakt mit Haut und Augen vermeiden; S36/37/39: Geeignete Schutzkleidung, Handschuhe und Augen-/Gesichtsschutz tragen. |
| UN-Identifikationsnummern | UN 1993, Entzündbare Flüssigkeit, NOS (4-Ethylphenol) |
| HS-Code | 2909.30.90 |
| Gefahrenklasse | 3 |
| Verpackungsgruppe | III |
| Toxizität | Oraler LD50 (Ratte) = 5.400 mg/kg. Kann Haut- und Augenreizungen verursachen. Das Einatmen der Dämpfe oder Nebel kann zu Reizungen der Atemwege führen. |
Methoden zur Synthese von 4-Ethylphenol
4-Ethylphenol wird durch die Reaktion von Phenol mit Ethylenoxid in Gegenwart eines alkalischen Katalysators wie Natriumhydroxid oder Kaliumhydroxid synthetisiert. Die Reaktion findet bei einer Temperatur von 60–80 °C und atmosphärischem Druck statt. Das Molverhältnis von Phenol zu Ethylenoxid variiert von 1:1 bis 1:2, abhängig von der gewünschten Ausbeute und Reinheit des 4-Ethylphenols. Die Reaktionsmischung wird dann neutralisiert und destilliert, um das gewünschte Produkt zu erhalten.
Eine alternative Synthesemethode beinhaltet die Reaktion von 4-Chlor-o-kresol mit Ethylenoxid in Gegenwart eines alkalischen Katalysators wie Natriumhydroxid oder Kaliumhydroxid. Die Reaktion findet bei einer Temperatur von 60–80 °C und atmosphärischem Druck statt. Das Molverhältnis von 4-Chlor-o-kresol zu Ethylenoxid variiert von 1:1 bis 1:2, abhängig von der gewünschten Ausbeute und Reinheit des 4-Ethylphenols. Die Reaktionsmischung wird dann neutralisiert und destilliert, um das gewünschte Produkt zu erhalten.
Es ist wichtig zu beachten, dass beide Methoden eine sorgfältige Kontrolle von Temperatur, Druck und Katalysatorkonzentration erfordern, um die gewünschte Ausbeute und Reinheit von 4-Ethylphenol zu erreichen. Um die Qualität des Endprodukts sicherzustellen, muss die Reaktionsmischung außerdem sorgfältig auf das Vorhandensein von Verunreinigungen wie Reaktionsnebenprodukten oder Verunreinigungen aus den Rohstoffen überwacht werden.
Verwendung von 4-Ethylphenol
Aufgrund seines süßen, würzigen Kräutergeruchs wird 4-Ethylphenol in der Industrie häufig als Duftstoff in Körperpflege- und Haushaltsprodukten wie Parfüms, Seifen, Reinigungsmitteln und Kerzen verwendet. Die Lebensmittelindustrie verwendet 4-Ethylphenol als Aromastoff in Süßigkeiten, Backwaren und alkoholischen Getränken. Als Vorprodukt werden auch andere Verbindungen, beispielsweise p-Kresol, für die Pharma- und Feinchemieindustrie hergestellt.
Hersteller verwenden 4-Ethylphenol bei der Herstellung von Harzen, Weichmachern und anderen Polymeren sowie bei der Synthese von Gummi und synthetischen Duftstoffen. Aufgrund seiner hemmenden Wirkung auf das Pilzwachstum untersuchen Forscher auch sein Potenzial als Antimykotikum.
Regulierungsbehörden wie die Europäische Union, die US-amerikanische Food and Drug Administration und die International Fragrance Association regeln die Verwendung von 4-Ethylphenol, um dessen sichere und verantwortungsvolle Verwendung zu gewährleisten. Die sichere Verwendung von 4-Ethylphenol erfordert eine sorgfältige Abwägung seiner möglichen Gesundheits- und Umweltauswirkungen sowie eine ordnungsgemäße Handhabung und Lagerung.
Fragen:
Was sind Ethylphenole?
Ethylphenole sind eine Gruppe organischer Verbindungen, die die funktionelle Phenolgruppe und eine an den Phenolring gebundene Ethylgruppe (-C2H5) enthalten. Sie werden als aromatische Alkohole klassifiziert und haben je nach Position der Ethylgruppe am Phenolring unterschiedliche physikalische und chemische Eigenschaften. Häufige Beispiele für Ethylphenole sind 4-Ethylphenol und 2-Ethylphenol. Diese Verbindungen finden vielfältige Verwendung in der Parfüm-, Lebensmittel- und Chemieindustrie sowie bei der Synthese anderer Chemikalien. Allerdings ist die Verwendung von Ethylphenolen aufgrund von Bedenken hinsichtlich ihrer möglichen Auswirkungen auf die Gesundheit und die Umwelt reguliert, und ihre sichere Verwendung erfordert eine sorgfältige Prüfung ihrer Handhabungs- und Lagerungsanforderungen.
Welche Struktur hat die Verbindung, die durch die Spektraldaten unten beschrieben wird? Formel c8h10o
Spektraldaten allein können die Struktur einer Verbindung nicht definitiv bestimmen, sie können jedoch Informationen zur Identifizierung dieser Verbindung liefern. Die Formel C8H10O legt nahe, dass es sich bei der Verbindung um einen aromatischen Alkohol handelt, was durch das Vorhandensein einer funktionellen Alkoholgruppe bestätigt werden kann, was durch einen OH-Peak im IR-Spektrum angezeigt wird.
Das 1H-NMR-Spektrum könnte Informationen über die Anzahl und Art der Wasserstoffatome im Molekül liefern, beispielsweise über das Vorhandensein aromatischer und aliphatischer Wasserstoffe sowie etwaiger funktioneller Gruppen. Das 13C-NMR-Spektrum könnte auch Aufschluss über die Art der im Molekül vorhandenen Kohlenstoffatome und deren Umgebung geben.
Basierend auf diesen Informationen ist es möglich, die Struktur der Verbindung abzuleiten, es wären jedoch zusätzliche Informationen und Analysen erforderlich, um sie endgültig zu bestätigen. Zu den möglichen Strukturen einer Verbindung mit der Formel C8H10O könnten unter anderem Phenol, Kresole oder Xylenole gehören.
Was ist Ihrer Meinung nach die Struktur des NMR-Spektrums, das durch die chemische Formel c8h10o dargestellt wird?
Mit der chemischen Formel C8H10O als aromatischer Alkohol können Sie die wahrscheinliche Struktur eines Moleküls bestimmen. Man würde im 1H-NMR-Spektrum ein Singulett- oder Dublettsignal für das Hydroxylproton und mehrere Peaks für das aromatische Protonensignal erwarten. Im 13C-NMR-Spektrum sehen Sie Signale für die Kohlenstoffe des aromatischen Rings und der Carbonylgruppe.
Mehrere Faktoren wie Umgebung, Lösungsmittel und Konzentration des Moleküls sowie Verunreinigungen oder Isomere können sich auf NMR-Spektren auswirken. Um die Struktur des Moleküls definitiv zu bestimmen, müssen Sie das tatsächliche NMR-Spektrum analysieren und interpretieren, obwohl Sie anhand der chemischen Formel eine Vorhersage treffen können.
Wie berechnet man den Grad der Ungesättigtheit von c8h10o?
Der Grad der Ungesättigtheit eines Moleküls kann mit der Formel berechnet werden:
Ungesättigtheitsgrad = (2 + Anzahl der Ringe) + (Anzahl der Doppelbindungen / 2)
Das Molekül der Formel C8H10O hat nur einen Ring, da es ein aromatischer Ring ist. Das Molekül hat keine Doppelbindungen, da es ein Alkohol ist und keine Doppelbindungen enthält.
Daher würden die Ungesättigtheitsgrade für C8H10O wie folgt berechnet:
Ungesättigtheitsgrade = (2 + 1) + (0/2) = 3
Dieses Ergebnis weist darauf hin, dass das C8H10O-Molekül drei Grad an Ungesättigtheit aufweist und daher wahrscheinlich ein aromatischer Alkohol ist. Die Berechnung des Ungesättigtheitsgrads bietet eine schnelle und bequeme Möglichkeit, die Molekülstruktur einer Verbindung abzuschätzen und festzustellen, ob sie ungesättigte funktionelle Gruppen oder Ringe enthält. Es ist jedoch zu beachten, dass diese Methode einige Einschränkungen aufweist und nicht für alle Verbindungen geeignet ist.
Was ist c8h10o?
C8H10O ist die chemische Formel für ein Molekül mit 8 Kohlenstoffatomen, 10 Wasserstoffatomen und 1 Sauerstoffatom. Das Molekül kann eine von vielen verschiedenen chemischen Verbindungen sein, darunter unter anderem aromatische Alkohole wie Phenol, Kresole oder Xylenole.
Techniken wie Infrarotspektroskopie, Kernspinresonanzspektroskopie oder Massenspektrometrie bestimmen die wahre Identität des Moleküls anhand seiner molekularen Struktur und Eigenschaften.
