Schwefelsäure (H2SO4) oder Vitriolöl ist eine stark ätzende und starke Mineralsäure, die häufig in verschiedenen industriellen Prozessen wie der Düngemittelproduktion, der Erdölraffinierung und der Metallverarbeitung verwendet wird. Es ist auch ein starkes Entwässerungsmittel.
| IUPAC-Name | Schwefelsäure |
| Molekularformel | H2SO4 |
| CAS-Nummer | 7664-93-9 |
| Synonyme | Vitriolöl, Schwefelsäureanhydrid, Bisschwefelsäure |
| InChI | InChI=1S/H2O4S/c2-1(3)4/h(H2,2,3,4)/p-1 |
Eigenschaften von Schwefelsäure
Schwefelsäureformel
Die chemische Formel für Schwefelsäure lautet H2SO4, was zwei Wasserstoffatome, ein Schwefelatom und vier Sauerstoffatome darstellt. Diese Formel stellt die Zusammensetzung des Schwefelsäuremoleküls und seine chemische Struktur dar.
Molmasse von Schwefelsäure
Die Molmasse von Schwefelsäure beträgt 98,08 g/mol. Sie wird berechnet, indem die Atommassen jedes Elements in der chemischen Formel für Schwefelsäure (H2SO4) addiert werden.
Siedepunkt von Schwefelsäure
Schwefelsäure hat einen Siedepunkt von 337,1 °C. Bei dieser Temperatur erreicht der Dampfdruck der Flüssigkeit den Atmosphärendruck und sie beginnt zu sieden.
Schmelzpunkt von Schwefelsäure
Der Schmelzpunkt von Schwefelsäure liegt bei 10,4°C. Bei Raumtemperatur ist es eine sehr viskose Flüssigkeit, bei niedrigeren Temperaturen kann es jedoch zu einem festen Zustand gefrieren.
Dichte der Schwefelsäure g/ml
Die Dichte von Schwefelsäure variiert je nach Konzentration zwischen 1,84 g/ml und 1,93 g/ml. Mit zunehmender Schwefelsäurekonzentration nimmt auch deren Dichte zu.
Molekulargewicht von Schwefelsäure
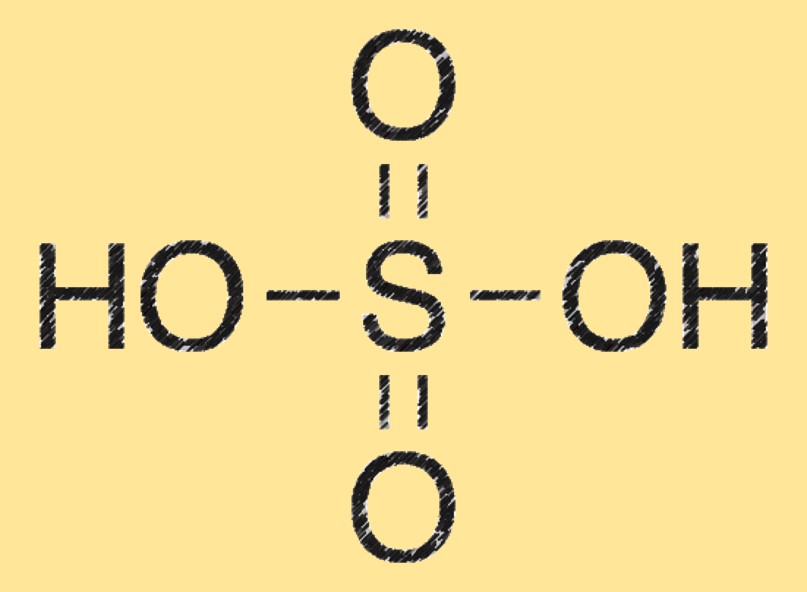
Das Molekulargewicht von Schwefelsäure beträgt 98,08 g/mol. Sie wird berechnet, indem die Atommassen jedes Elements in seiner chemischen Formel (H2SO4) addiert werden.
Struktur von Schwefelsäure
Das Schwefelsäuremolekül besteht aus zwei Wasserstoffatomen (H), die an ein Schwefelatom (S) gebunden sind, das außerdem an vier Sauerstoffatome (O) gebunden ist. Es hat eine tetraedrische Molekülgeometrie und ist ein starkes Dehydratisierungsmittel.
| Aussehen | Klare, farblose, ölige Flüssigkeit |
| Spezifisches Gewicht | 1,84 (Wasser = 1) |
| Farbe | Farblos |
| Geruch | Scharfer und schwefeliger Geruch |
| Molmasse | 98,079 g/Mol |
| Dichte | 1.835 g/ml |
| Fusionspunkt | 10,5°C |
| Siedepunkt | 337°C |
| Blitzpunkt | 140°F (60°C) |
| Löslichkeit in Wasser | Völlig mischbar |
| Löslichkeit | Löslich in Wasser und Alkohol |
| Dampfdruck | 40 mmHg (20°C) |
| Wasserdampfdichte | 2,5 (Luft = 1) |
| pKa | -3 |
| pH-Wert | Weniger als 1 (stark sauer) |
Sicherheit und Gefahren von Schwefelsäure
Schwefelsäure ist eine stark ätzende und gefährliche Substanz. Kontakt mit Haut und Augen kann zu schweren Verbrennungen und Blindheit führen. Das Einatmen seiner Dämpfe kann die Atemwege reizen und Husten, pfeifende Atemgeräusche und Kurzatmigkeit verursachen. Es ist brennbar und reaktiv und sollte in einem gut belüfteten Bereich mit Vorsicht und unter Verwendung von Schutzausrüstung wie Handschuhen und Augenschutz gehandhabt werden. Verschüttungen sollten sofort beseitigt werden, um eine Beschädigung von Oberflächen und eine potenzielle Schädigung von Personen zu vermeiden. Um eine sichere Handhabung zu gewährleisten, sind eine ordnungsgemäße Lagerung und Kennzeichnung erforderlich.
| Gefahrensymbole | Ätzend, reizend, schädlich |
| Sicherheitsbeschreibung | Von Hitze/Funken/offener Flamme/heißen Oberflächen fernhalten. Rauchen verboten. An einem gut belüfteten Ort aufbewahren. Halten Sie den Behälter fest verschlossen. Schutzhandschuhe/Schutzkleidung/Augenschutz/Gesichtsschutz tragen. |
| UN-Identifikationsnummern | UN1830 |
| HS-Code | 2815.11.00 |
| Gefahrenklasse | 8 |
| Verpackungsgruppe | II |
| Toxizität | Oral: LD50 = 1,2 g/kg (Ratte) |
Methoden zur Synthese von Schwefelsäure
H2SO4 kann durch verschiedene Methoden synthetisiert werden, einschließlich des Kontaktverfahrens und des Hauptkammerverfahrens.
Das Kontaktverfahren ist das am weitesten verbreitete Verfahren zur industriellen Herstellung von Schwefelsäure, bei dem Schwefeldioxid zu Schwefeltrioxid oxidiert und das Schwefeltrioxid anschließend mit Wasser zu H2SO4 umgesetzt wird.
Beim Bleikammerverfahren hingegen erfolgt die Oxidation von Schwefeldioxid mit Stickstoffdioxid in Gegenwart eines Katalysators, meist Bleidioxid, und die anschließende Reaktion des resultierenden Schwefeltrioxids mit Wasser. Bei beiden Methoden entsteht H2SO4 mit unterschiedlichem Reinheitsgrad und unterschiedlicher Konzentration, das je nach Bedarf weiter gereinigt und konzentriert werden kann.
Verwendung von Schwefelsäure
H2SO4 ist eine vielseitige Chemikalie und wird in verschiedenen Branchen häufig eingesetzt. Schwefelsäure wird üblicherweise zur Herstellung von Düngemitteln, Waschmitteln, Farbstoffen und Pigmenten verwendet. Es spielt auch eine Rolle bei der Raffinierung von Erdölprodukten, der Verarbeitung von Mineralien und Erzen sowie der Produktion von Chemikalien wie Salpetersäure und Sulfaten. Labore verwenden H2SO4 als Reagens und dienen als Katalysator bei chemischen Reaktionen. Blei-Säure-Batterien verwenden Schwefelsäure als Elektrolyt und Stahlhersteller verwenden sie zum Beizen, um Rost und Zunder vor dem Galvanisieren oder Lackieren zu entfernen.
Insgesamt spielt H2SO4 in vielen industriellen Prozessen eine entscheidende Rolle und ist damit eine der wichtigsten Chemikalien weltweit.
Fragen:
Ist Schwefelsäure eine starke Säure?
Ja, H2SO4 ist eine starke Säure. Eine starke Säure ist eine Säure, die in Wasser vollständig dissoziiert und Wasserstoffionen (H+) erzeugt, was bedeutet, dass sie alle ihre Wasserstoffionen an die Lösung abgibt. Schwefelsäure gilt als eine der stärksten Säuren und hat einen hohen Säuregehalt, was sie sehr reaktiv und ätzend macht. Um Schäden für Mensch und Umwelt zu vermeiden, ist die ordnungsgemäße Handhabung und Lagerung von Schwefelsäure unerlässlich.
Wofür wird Schwefelsäure verwendet?
Schwefelsäure wird in verschiedenen Branchen und Anwendungen häufig verwendet. Zu den häufigsten Anwendungen von H2SO4 gehören:
- Düngemittelherstellung: Schwefelsäure wird bei der Herstellung von Phosphorsäure verwendet, die ein wichtiger Bestandteil vieler Düngemittel ist.
- Ölraffinierung: Schwefelsäure wird verwendet, um während des Raffinierungsprozesses Verunreinigungen wie Schwefelverbindungen aus Rohöl zu entfernen.
- Metallverarbeitung: Schwefelsäure wird in der Metallverarbeitung zum Entfernen von Rost und Zunder aus Eisen und Stahl sowie zur Raffinierung von Metallerzen verwendet.
- Herstellung: Schwefelsäure wird bei der Herstellung einer Vielzahl von Produkten verwendet, darunter Reinigungsmittel, Farbstoffe, Pigmente und andere Chemikalien.
- Autobatterien: Schwefelsäure wird als Elektrolyt in Blei-Säure-Batterien verwendet, die üblicherweise in Autos und anderen Fahrzeugen verwendet werden.
- Laborreagenz: Schwefelsäure wird aufgrund ihrer hohen Reaktivität und ihrer Fähigkeit, viele Substanzen aufzulösen, häufig als Laborreagenz verwendet.
Welche Art von Säure ist Schwefelsäure?
H2SO4 ist eine starke anorganische Säure. H2SO4 wird als diprotische Säure klassifiziert und gibt zwei Wasserstoffionen (H+) an eine Lösung ab, was sie zu einer starken Mineralsäure macht. Aufgrund seiner hochreaktiven und korrosiven Natur muss bei der Handhabung und Lagerung von H2SO4 vorsichtig vorgegangen werden, um Schäden für Mensch und Umwelt zu vermeiden. Die Industrie nutzt Schwefelsäure in großem Umfang in ihren Prozessen, unter anderem bei der Herstellung von Düngemitteln, Waschmitteln, Farbstoffen, Pigmenten und anderen Chemikalien sowie bei der Raffinierung von Erdölprodukten und der Verarbeitung von Metallerzen.
Wie lautet die Formel für Schwefelsäure?
Die chemische Formel für Schwefelsäure lautet H2SO4.
Was ist Vitriolöl?
Vitriolöl ist eine andere Bezeichnung für Schwefelsäure, eine starke und stark ätzende Chemikalie. Es wird häufig bei der Herstellung von Düngemitteln, Waschmitteln und Farbstoffen sowie bei der Erdölraffinierung und der Verarbeitung anderer Chemikalien verwendet.
