Isopren (C5H8) ist eine natürliche organische Verbindung, die bei der Herstellung von Gummi, Kunststoffen und anderen Materialien verwendet wird. Es spielt eine entscheidende Rolle bei der Entstehung von Ozon und der Luftverschmutzung.
| IUPAC-Name | 2-Methylbuta-1,3-dien |
| Molekularformel | C₅H₈ |
| CAS-Nummer | 78-79-5 |
| Synonyme | Isopren, 2-Methyl-1,3-butadien, β-Isopren |
| InChI | InChI=1S/C₅H₈/c1-4-5(2)3/h4H,1-2H3 |
Eigenschaften von Isopren
Isopren-Formel
Die Formel für Isopren lautet C₅H₈. Es besteht aus fünf Kohlenstoffatomen und acht Wasserstoffatomen. Die Molekülstruktur von Isopren zeichnet sich durch eine verzweigte Kette mit einer Doppelbindung zwischen dem zweiten und dritten Kohlenstoffatom aus.
Molmasse von Isopren
Die Molmasse von 2-Methyl-1,3-butadien kann durch Addition der Atommassen seiner Bestandteile berechnet werden. Kohlenstoff hat eine Molmasse von 12,01 g/mol, während Wasserstoff eine Molmasse von 1,01 g/mol hat. Somit beträgt die Molmasse von 2-Methyl-1,3-butadien etwa 68,12 g/mol.
Siedepunkt von Isopren
Isopren hat einen Siedepunkt von etwa 34 °C (93 °F). Dieser relativ niedrige Siedepunkt macht es flüchtig und neigt bei Raumtemperatur zur Verdunstung.
Schmelzpunkt von Isopren
Der Schmelzpunkt von 2-Methyl-1,3-butadien liegt bei etwa -145 °C (-229 °F). Bei dieser Temperatur geht 2-Methyl-1,3-butadien vom festen in den flüssigen Zustand über.
Isoprendichte g/ml
Die Dichte von 2-Methyl-1,3-butadien beträgt etwa 0,69 g/ml. Dieser Wert stellt die Masse von 2-Methyl-1,3-butadien pro Volumeneinheit dar und wird durch sein Molekulargewicht und seine strukturelle Anordnung beeinflusst.
Molekulargewicht von Isopren
Das Molekulargewicht von 2-Methyl-1,3-butadien wird durch Addition der Atomgewichte seiner Atombestandteile bestimmt. Mit der Formel C₅H₈ beträgt das Molekulargewicht von 2-Methyl-1,3-butadien etwa 68,12 g/mol.
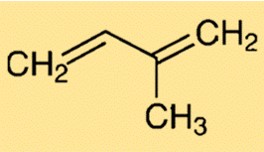
Isopren-Struktur
Die Struktur von 2-Methyl-1,3-butadien ist durch eine verzweigte Kette aus fünf Kohlenstoffatomen gekennzeichnet. Es enthält eine Doppelbindung zwischen dem zweiten und dritten Kohlenstoffatom. Diese Struktur verleiht 2-Methyl-1,3-butadien Flexibilität und Reaktivität und macht es zu einem Schlüsselelement bei der Synthese verschiedener Verbindungen.
Löslichkeit von Isopren
Isopren ist in Wasser schlecht löslich, löst sich jedoch leicht in organischen Lösungsmitteln wie Ethanol und Aceton. Seine Löslichkeitseigenschaften werden auf die unpolare Natur seiner Molekülstruktur zurückgeführt.
Diese Hinweise bieten einen Überblick über die wichtigsten Eigenschaften von 2-Methyl-1,3-butadien, einschließlich seiner Formel, Molmasse, Siedepunkt, Schmelzpunkt, Dichte, Molekulargewicht, Struktur und Löslichkeit. Das Verständnis dieser Eigenschaften ist für die Untersuchung und Verwendung von 2-Methyl-1,3-butadien in verschiedenen industriellen Anwendungen von entscheidender Bedeutung.
| Aussehen | Farblose Flüssigkeit |
| Spezifisches Gewicht | 0,68 – 0,70 g/ml |
| Farbe | Farblos |
| Geruch | Süß, würzig |
| Molmasse | 68,12 g/Mol |
| Dichte | 0,68 – 0,70 g/ml |
| Fusionspunkt | -145 °C (-229 °F) |
| Siedepunkt | 34°C (93°F) |
| Blitzpunkt | -40°C (-40°F) |
| Löslichkeit in Wasser | Schwer löslich |
| Löslichkeit | Löslich in organischen Lösungsmitteln |
| Dampfdruck | 290 mmHg bei 25°C |
| Wasserdampfdichte | 2,49 (Luft = 1) |
| pKa | ~40 |
| pH-Wert | Neutral |
Sicherheit und Gefahren von Isopren
Isopren oder 2-Methyl-1,3-Butadien birgt bestimmte Sicherheitsrisiken, die berücksichtigt werden müssen. Es ist leicht entzündlich und kann explosionsfähige Dampf-Luft-Gemische bilden. Es sollte daher in der Nähe von offenem Feuer oder Wärmequellen mit Vorsicht gehandhabt werden. Die Einwirkung von Isopren kann zu Haut- und Augenreizungen führen. Längerer oder wiederholter Kontakt kann Dermatitis verursachen. Das Einatmen von 2-Methyl-1,3-butadien-Dämpfen kann zu Reizungen der Atemwege, Schwindel und Kopfschmerzen führen. Bei der Arbeit mit 2-Methyl-1,3-butadien ist es wichtig, für ausreichende Belüftung und persönliche Schutzausrüstung zu sorgen. Bei Verschlucken ist sofortige ärztliche Hilfe erforderlich. Es empfiehlt sich, 2-Methyl-1,3-butadien an einem kühlen, gut belüfteten Ort, entfernt von Zündquellen, aufzubewahren.
| Gefahrensymbole | Entzündlich (F), Reizend (Xi) |
| Sicherheitsbeschreibung | Von Hitze/Funken/offener Flamme/heißen Oberflächen fernhalten. Einatmen von Staub/Rauch/Gas/Nebel/Dampf/Spray vermeiden. Schutzhandschuhe/Augenschutz/Gesichtsschutz tragen. An einem gut belüfteten Ort aufbewahren. |
| UN-Identifikationsnummern | UN 1214 |
| HS-Code | 2902.41.00 |
| Gefahrenklasse | Klasse 3 (Brennbare Flüssigkeiten) |
| Verpackungsgruppe | GE II |
| Toxizität | Kann Haut- und Augenreizungen verursachen. Gesundheitsschädlich beim Verschlucken. |
Methoden zur Isopren-Synthese
Verschiedene Methoden können 2-Methyl-1,3-butadien synthetisieren. Eine gängige Methode ist das thermische Cracken erdölbasierter Rohstoffe wie Naphtha oder leichte Gase in Gegenwart von Katalysatoren. Bei diesem Prozess entsteht eine Mischung von Verbindungen, darunter 2-Methyl-1,3-butadien, die wir trennen und reinigen können.
Eine weitere Methode ist die katalytische Dehydrierung von Isopentan oder Isobutan . Unter kontrollierten Bedingungen und mit Hilfe eines Katalysators durchlaufen diese Kohlenwasserstoffe eine Dehydrierungsreaktion, bei der 2-Methyl-1,3-butadien entsteht.
Wir können 2-Methyl-1,3-butadien auch auf biologischen Wegen aus erneuerbaren Quellen gewinnen. Durch die genetische Veränderung von Mikroorganismen wie Bakterien und Hefen ermöglichen wir ihnen, über Stoffwechselwege 2-Methyl-1,3-butadien zu produzieren. Dieser Ansatz bietet eine nachhaltige und umweltfreundliche Alternative zu herkömmlichen Synthesemethoden.
Darüber hinaus können durch Biomassepyrolyse, ein thermochemischer Prozess, 2-Methyl-1,3-butadien sowie andere wertvolle Chemikalien erzeugt werden. Werden Biomassematerialien in Abwesenheit von Sauerstoff hohen Temperaturen ausgesetzt, werden die komplexen organischen Verbindungen in der Biomasse zersetzt und 2-Methyl-1,3-butadien als eines der resultierenden Produkte freigesetzt.
Insgesamt umfasst die Synthese von 2-Methyl-1,3-butadien eine Reihe von Methoden, darunter thermisches Cracken, katalytische Dehydrierung, biologische Wege und Biomassepyrolyse. Diese verschiedenen Ansätze tragen dazu bei, 2-Methyl-1,3-butadien für verschiedene industrielle Anwendungen verfügbar zu machen und dabei Umwelt- und Nachhaltigkeitsaspekte zu berücksichtigen.
Verwendungsmöglichkeiten von Isopren
Aufgrund seiner einzigartigen Eigenschaften und Reaktivität spielt Isopren in verschiedenen Branchen eine entscheidende Rolle. Es findet zahlreiche Anwendungen in den folgenden Bereichen:
- Kautschukproduktion: Hersteller verwenden 2-Methyl-1,3-Butadien als essentielles Monomer zur Herstellung von synthetischem Kautschuk, einschließlich Poly2-Methyl-1,3-Butadien und Styrol-Butadien-Kautschuk (SBR). Sie verwenden diese Kautschuke zur Herstellung von Reifen, Förderbändern, Rohren und verschiedenen geformten Gummiprodukten.
- Polymerherstellung: Isopren dient als Grundelement bei der Herstellung verschiedener Polymerharze und Elastomere. Industrien nutzen es zur Synthese thermoplastischer Elastomere, Klebstoffe, Beschichtungen und Dichtstoffe.
- Chemische Zwischenprodukte: Isopren erweist sich als vielseitiges chemisches Zwischenprodukt bei der Herstellung einer Vielzahl von Chemikalien. Es erleichtert die Synthese von Arzneimitteln, Duftstoffen, Aromen, Antioxidantien und anderen Spezialchemikalien.
- Ozonbildung: Isopren trägt erheblich zur Atmosphärenchemie bei, indem es mit Stickoxiden (NOx) und Sonnenlicht unter Bildung von Ozon reagiert. Dieser Prozess beeinträchtigt die Luftqualität und trägt zur Smogbildung bei.
- Kraftstoffzusatz: Die Industrie verwendet 2-Methyl-1,3-butadien als Kraftstoffzusatz, um die Verbrennungseffizienz und die Leistungseigenschaften von Benzin zu verbessern. Es verbessert die Oktanzahl und reduziert das Klopfen des Motors.
- Forschung und Entwicklung: Isopren spielt eine wichtige Rolle in Forschungs- und Entwicklungsstudien, insbesondere in den Bereichen Chemie, Materialwissenschaften und Umweltwissenschaften. Forscher nutzen es häufig als wertvolles Werkzeug zur Untersuchung neuer Reaktionen, zur Entwicklung innovativer Materialien und zur Untersuchung der Atmosphärenchemie.
Die vielfältigen Anwendungen von 2-Methyl-1,3-butadien unterstreichen seine Bedeutung in zahlreichen Branchen, die von der Kautschukherstellung bis zur chemischen Synthese reichen, und spielen gleichzeitig eine Rolle in der Umwelt- und wissenschaftlichen Forschung.
Fragen:
F: Was ist die Isopren-Regel?
A: Die 2-Methyl-1,3-Butadien-Regel besagt, dass viele natürliche Verbindungen aus 2-Methyl-1,3-Butadien abgeleitet werden können, das aus fünf Kohlenstoffatomen besteht und eine verzweigte Struktur aufweist.
F: Wie viele Isopren-Einheiten enthält Alpha-Ylangen?
A: Alpha-Ylangen enthält drei 2-Methyl-1,3-Butadien-Einheiten, da es eine gerade Kette aus 15 Kohlenstoffatomen aufweist, die aus drei Bausteinen von 2-Methyl-1,3-Butadien abgeleitet sind.
F: Wie viele Isopreneinheiten werden zur Synthese eines Cholesterinmoleküls benötigt?
A: Die Synthese eines Cholesterinmoleküls erfordert 18 2-Methyl-1,3-butadien-Einheiten, die durch eine Reihe enzymatischer Reaktionen kombiniert und modifiziert werden.
F: Wie viele Einheiten Isopren enthält Cholesterin?
A: Cholesterin enthält vier kondensierte Ringe und besteht aus 30 2-Methyl-1,3-butadien-Einheiten.
F: Wie identifiziere ich Isopren-Einheiten?
A: 2-Methyl-1,3-butadien-Einheiten sind an ihrer charakteristischen Struktur zu erkennen, die aus einer verzweigten Kette aus fünf Kohlenstoffatomen mit einer Doppelbindung zwischen dem zweiten und dritten Kohlenstoffatom besteht.
F: Welche Position hat die Menthylgruppe bei Isopren?
A: Die Menthylgruppe befindet sich normalerweise am vierten Kohlenstoffatom einer 2-Methyl-1,3-butadien-Einheit.
F: Besteht der 4-Carbon-Ring aus Isopren?
A: Nein, ein 4-Kohlenstoff-Ring ist nicht 2-Methyl-1,3-butadien. 2-Methyl-1,3-butadien bezeichnet eine spezifische Einheit mit fünf Kohlenstoffatomen, einer verzweigten Struktur und einer Doppelbindung.
F: Wie viele Isopren-Einheiten enthält Squalen?
A: Squalen, ein Triterpen, besteht aus sechs 2-Methyl-1,3-butadien-Einheiten, was ein Molekül mit 30 Kohlenstoffatomen ergibt.
