Isobutylen (C₄H₈) ist ein farbloses Gas, das bei der Herstellung von Kraftstoffen und Chemikalien verwendet wird. Es ist leicht entflammbar und hat einen süßlichen Geruch.
| IUPAC-Name | 2-Methylpropen |
| Molekularformel | C₄H₈ |
| CAS-Nummer | 115-11-7 |
| Synonyme | Isobuten, 2-Methylpropen, Methylpropen |
| InChI | InChI=1S/C4H8/c1-4(2)3/h1H2.2-3H3 |
Eigenschaften von Isobutylen
Isobutylen-Formel
Die Formel für Isobuten lautet C₄H₈. Es besteht aus vier Kohlenstoffatomen und acht Wasserstoffatomen. Diese Summenformel stellt die Zusammensetzung von Isobuten dar und zeigt die Anzahl jeder in einem Molekül vorhandenen Atomart an.
Isobutylen-Molmasse
Die Molmasse von Isobuten wird durch Addition der Atommassen seiner Atombestandteile berechnet. Das sind ungefähr 56,11 Gramm pro Mol (g/mol). Die Molmasse ist ein entscheidender Parameter bei chemischen Berechnungen und wird verwendet, um zu bestimmen, wie viel einer Substanz in einer bestimmten Menge vorhanden ist.
Siedepunkt von Isobutylen
Isobutylen hat einen Siedepunkt von etwa -6,9 Grad Celsius. Der Siedepunkt bezieht sich auf die Temperatur, bei der ein Stoff unter normalem Atmosphärendruck von der flüssigen Phase in die gasförmige Phase übergeht. Bei dieser Temperatur verdampft Isobutylen und wird gasförmig.
Isobutylen Schmelzpunkt
Der Schmelzpunkt von Isobuten liegt bei etwa -140,3 Grad Celsius. Der Schmelzpunkt ist die Temperatur, bei der ein fester Stoff in den flüssigen Zustand übergeht. Isobutylen erfährt diese Veränderung, wenn es auf die angegebene Temperatur erhitzt wird.
Dichte von Isobutylen g/ml
Die Dichte von Isobuten beträgt etwa 0,588 Gramm pro Milliliter (g/ml). Die Dichte gibt die Masse pro Volumeneinheit eines Stoffes an. Es bestimmt den Grad der Dichte von Molekülen in einem bestimmten Materialvolumen.
Molekulargewicht von Isobutylen
Das Molekulargewicht von Isobuten beträgt etwa 56,11 Gramm pro Mol (g/mol). Das Molekulargewicht ist die Summe der Atomgewichte aller Atome in einem Molekül. Es ist für verschiedene Berechnungen unerlässlich, einschließlich der Stöchiometrie und der Bestimmung des Anteils verschiedener Elemente in einer Verbindung.
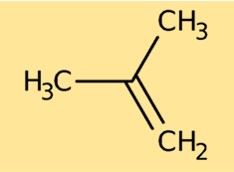
Struktur von Isobutylen
Isobuten hat eine Struktur, die aus einer verzweigten Kette aus vier Kohlenstoffatomen besteht. Jedes Kohlenstoffatom ist an andere Atome gebunden, insbesondere an Wasserstoffatome. Die Struktur wird durch CH₃C(CH₃)CH₂ dargestellt. Diese Anordnung der Atome bestimmt die chemischen und physikalischen Eigenschaften von Isobuten.
Löslichkeit von Isobutylen
Isobuten ist in Wasser schlecht löslich. Aufgrund seiner unpolaren Natur weist es eine geringe Löslichkeit auf. Unpolare Verbindungen wie Isobuten lösen sich nicht leicht in polaren Lösungsmitteln wie Wasser. Isobuten kann sich jedoch in organischen Lösungsmitteln wie Alkoholen, Ethern und Kohlenwasserstoffen lösen.
| Aussehen | Farbloses Gas |
| Spezifisches Gewicht | 0,588 |
| Farbe | N / A |
| Geruch | Weich |
| Molmasse | 56,11 g/Mol |
| Dichte | 0,588 g/ml |
| Fusionspunkt | -140,3°C |
| Siedepunkt | -6,9°C |
| Blitzpunkt | -49°C |
| Löslichkeit in Wasser | Schwer löslich |
| Löslichkeit | Löslich in organischen Lösungsmitteln |
| Dampfdruck | 215 kPa (bei 25°C) |
| Wasserdampfdichte | 2,48 (Luft = 1) |
| pKa | N / A |
| pH-Wert | Neutral |
Sicherheit und Gefahren von Isobutylen
Isobuten birgt mehrere Sicherheitsrisiken. Es ist leicht entzündlich, das heißt, es kann sich leicht entzünden, wenn es einer Zündquelle ausgesetzt wird. Daher müssen entsprechende Vorkehrungen getroffen werden, um Brände und Explosionen zu vermeiden. Isobutendämpfe sind schwerer als Luft und können sich in tiefer gelegenen Bereichen ansammeln, was die Brandgefahr erhöht. Direkter Kontakt mit Isobuten kann zu Haut- und Augenreizungen führen. Das Einatmen hoher Konzentrationen kann zu Atembeschwerden, Schwindel und sogar Erstickung führen. Beim Umgang mit Isobuten sollten ausreichende Belüftung und persönliche Schutzausrüstung verwendet werden, um das Risiko einer Exposition zu minimieren. Es ist wichtig, die entsprechenden Sicherheitsprotokolle zu befolgen und mit dieser Substanz vorsichtig umzugehen.
| Gefahrensymbole | Brennbares Gas |
| Sicherheitsbeschreibung | Von Zündquellen fernhalten. |
| In einem gut belüfteten Bereich verwenden. | |
| Tragen Sie Schutzkleidung und Schutzbrille. | |
| Identifikatoren der Vereinten Nationen | UN 1075 |
| HS-Code | 2901.11.00 |
| Gefahrenklasse | 2.1 (Brennbares Gas) |
| Verpackungsgruppe | GE II |
| Toxizität | Akute Toxizität beim Einatmen, gesundheitsschädlich bei Verschlucken oder bei Haut-/Augenkontakt. |
Methoden zur Synthese von Isobutylen
Es gibt verschiedene Methoden zur Synthese von Isobuten.
Eine übliche Methode beinhaltet die katalytische Dehydrierung von Isobutan, wobei das Isobutan bei erhöhten Temperaturen über einen Katalysator, üblicherweise ein Metalloxid oder einen Metallträgerkatalysator, geleitet wird. Der Katalysator erleichtert die Entfernung von Wasserstoff aus Isobutan, was zur Bildung von Isobuten führt.
Bei einer anderen Methode werden Erdölfraktionen, die reich an verzweigten Kohlenwasserstoffen wie Butenen sind, durch Anwendung hoher Temperaturen thermisch gecrackt. Bei der Crackreaktion werden größere Kohlenwasserstoffmoleküle in kleinere Moleküle zerlegt, wodurch Isobuten entsteht.
Beim Dampfcracken von Kohlenwasserstoffen entsteht als Nebenprodukt Isobuten. Beim Dampfcracken werden Kohlenwasserstoffe wie Ethan oder Naphtha in Gegenwart von Dampf hohen Temperaturen ausgesetzt, wodurch ein Gemisch aus Olefinen, einschließlich Isobuten, entsteht.
Darüber hinaus beinhaltet die Synthese von Isobuten die Durchführung einer Metathesereaktion zwischen Ethylen und 2-Buten . Bei Metathesereaktionen kommt es zum Austausch funktioneller Gruppen oder Substituenten zwischen reagierenden Molekülen. Indem Ethylen und 2-Buten Metathesebedingungen ausgesetzt werden, kann Isobuten hergestellt werden.
Diese Synthesemethoden bieten unterschiedliche Ansätze zur Gewinnung von Isobuten und erfüllen unterschiedliche industrielle Anforderungen und Verfügbarkeit von Rohstoffen. Jede Methode hat ihre eigenen Vorteile und Überlegungen hinsichtlich der Reaktionsbedingungen, der Katalysatorauswahl und der Optimierung der Ausbeute.
Verwendung von Isobutylen
Aufgrund seiner einzigartigen Eigenschaften spielt Isobuten in einer Vielzahl von Anwendungen eine entscheidende Rolle. Zu den häufigsten Anwendungen von Isobuten gehören:
- Isobuten ist aufgrund seiner hervorragenden Beständigkeit gegen Hitze, Chemikalien und seiner Undurchlässigkeit für Gase ein wichtiger Rohstoff bei der Herstellung von Butylkautschuk, den Hersteller zur Herstellung von Reifenschläuchen, Automobilschläuchen und Dichtungen verwenden.
- Die Industrie verwendet Isobuten als Kraftstoffzusatz, um die Oktanzahl von Benzin zu verbessern und dadurch die Verbrennungseffizienz zu verbessern und Klopfen zu reduzieren, was zu einer besseren Kraftstoffleistung führt.
- Isobuten wird einer Polymerisation unterzogen, um Polyisobuten (PIB) zu erzeugen, ein vielseitiges Polymer, das in verschiedenen industriellen Anwendungen wie Schmiermitteln, Klebstoffen, Dichtungsmitteln und als Verdickungsmittel weit verbreitet ist.
- Hersteller verwenden Isobuten als Vorstufe bei der Herstellung von Isobutylalkohol, einem Lösungsmittel, das häufig in Beschichtungen, Harzen und Körperpflegeprodukten verwendet wird.
- Isobuten fungiert als Baustein für die Synthese verschiedener Chemikalien, darunter Antioxidantien, Weichmacher, Aromen, Duftstoffe und Pharmazeutika, und demonstriert damit seine Rolle als wertvolles chemisches Zwischenprodukt.
- Die Industrie fügt Isobuten zu Flüssiggas (LPG) als Mischkomponente hinzu, um dessen Qualität und Stabilität zu verbessern und eine sichere und effiziente Verwendung zu gewährleisten.
- Es findet Anwendung als Komponente in Kältemittelmischungen, die in Kühl- und Klimaanlagen eingesetzt werden.
- Die Industrie verlässt sich auf Isobuten-Klebstoffe wegen ihrer starken Klebeeigenschaften und verwendet sie im Bau-, Automobil- und Verpackungssektor.
- Isobuten wird als Extraktionsmittel bei der Herstellung verschiedener Chemikalien, darunter Pharmazeutika und Aromastoffe, verwendet.
- Es dient als Treibmittel in Aerosolprodukten wie Sprays, Schäumen und Deodorants.
Diese Anwendungen verdeutlichen die Bedeutung von Isobuten in verschiedenen Branchen und seinen Beitrag zu vielen Alltagsprodukten.
Fragen:
F: Wie viel wiegt eine Gallone Isobutylen?
A: Eine Gallone Isobuten wiegt etwa 4,88 Pfund (lb).
F: Was ist Isobutylen?
A: Isobuten ist ein farbloses Gas, das bei der Herstellung von Kraftstoffen, Chemikalien und synthetischem Gummi verwendet wird.
F: Enthält Isobutylen cis- oder trans-Isomere?
A: Isobuten hat keine cis- oder trans-Isomere, da es ein verzweigter Kohlenwasserstoff ist.
F: Hat Isobutylen eine Vinylgruppe?
A: Ja, Isobutylen enthält eine Vinylgruppe, genauer gesagt eine Doppelbindung zwischen zwei Kohlenstoffatomen.
F: Ist Isobutylen in RP1 vorhanden?
A: Nein, Isobuten ist kein Bestandteil von RP-1 (Rocket Propellant-1), einer hochraffinierten Form von Kerosin.
F: Warum hat Isobutylen (-7 °C) einen niedrigeren Siedepunkt als Aceton (56 °C)?
A: Isobuten hat aufgrund seines geringeren Molekulargewichts und der schwächeren intermolekularen Kräfte einen niedrigeren Siedepunkt als Aceton.
F: Welche der folgenden Verbindungen eignet sich zur Förderung der kationischen Polymerisation von Isobutylen?
A: Lewissäuren wie Bortrifluorid (BF3) oder Aluminiumchlorid (AlCl3) können verwendet werden, um die kationische Polymerisation von Isobutylen zu fördern.
F: Wie wird Isobutylen gelagert?
A: Isobuten wird normalerweise in Behältern oder Zylindern unter Druck gelagert, um es in einem gasförmigen Zustand zu halten.
F: Welche organischen Bromide würden einer E2-Dehydrohalogenierung unterzogen, um Isobutylen als reines Alken zu ergeben?
A: 2-Brombutan (sec-Butylbromid) oder tert-Butylbromid können einer E2-Dehydrohalogenierung unterzogen werden, um Isobutylen als reines Alken zu erzeugen.
