Calciumcarbid ist eine chemische Verbindung mit der Formel CaC2. Es wird hauptsächlich zur Herstellung von Acetylengas und Kalkstickstoff verwendet. Es reagiert mit Wasser unter Bildung von Acetylengas und Calciumhydroxid. Die Menschen verwenden es zum Schweißen und Beleuchten.
| Name der IUPAC | Calciumethindiid |
| Molekularformel | CaC2 |
| CAS-Nummer | 75-20-7 |
| Synonyme | Calciumacetylid, Calciumperkohlenstoff, Calciumdicarbid, Calciumcarburo, Carburo calcico, Calciumethindiid |
| InChI | InChI=1S/C2.Ca/c1-2;/q-2;+2 |
Eigenschaften von Calciumcarbid
Calciumcarbid-Formel
Die chemische Formel für Calciumcarbid lautet CaC2. Das bedeutet, dass ein Calciumcarbid-Molekül aus einem Calciumatom und zwei Kohlenstoffatomen besteht. Die Formel zeigt das Verhältnis der Elemente der Verbindung.
Molmasse von Calciumcarbid
Die Molmasse von CaC2 beträgt 64,099 g/mol. Das bedeutet, dass ein Mol CaC2 eine Masse von 64.099 Gramm hat. Die Molmasse wird durch Addition der Atommassen der Elemente in der Formel berechnet. Die Atommasse von Kalzium beträgt 40,078 g/mol und die von Kohlenstoff 12,011 g/mol.
Siedepunkt von Calciumcarbid
Der Siedepunkt von CaC2 liegt bei 2300°C. Das bedeutet, dass CaC2 bei dieser Temperatur von flüssig in gasförmig übergeht. Der Siedepunkt wird durch intermolekulare Kräfte und den Atmosphärendruck beeinflusst. CaC2 verfügt über starke Ionenbindungen, deren Spaltung viel Energie erfordert.
Calciumcarbid Schmelzpunkt
Der Schmelzpunkt von CaC2 liegt bei 2160°C. Das bedeutet, dass CaC2 bei dieser Temperatur vom festen in den flüssigen Zustand übergeht. Der Schmelzpunkt wird auch durch intermolekulare Kräfte und den Atmosphärendruck beeinflusst. CaC2 hat aufgrund seiner starken Ionenbindungen einen hohen Schmelzpunkt.
Dichte von Calciumcarbid g/ml
Die Dichte von CaC2 beträgt 2,22 g/ml. Das bedeutet, dass ein Milliliter CaC2 eine Masse von 2,22 Gramm hat. Die Dichte wird berechnet, indem man Masse durch Volumen dividiert. Die Dichte hängt von der Konfiguration und Anordnung der Atome oder Moleküle in der Substanz ab. CaC2 hat eine hohe Dichte, da seine Atome in einer Kristallstruktur dicht aneinander gepackt sind.
Molekulargewicht von Calciumcarbid
Das Molekulargewicht von CaC2 beträgt 64.099 amu (atomare Masseneinheiten). Das bedeutet, dass ein CaC2-Molekül eine Masse von 64.099 amu hat. Das Molekulargewicht wird berechnet, indem die Atommassen der Elemente in der Formel mit ihrer jeweiligen Anzahl an Atomen multipliziert werden. Die Atommasse von Kalzium beträgt 40,078 amu und die von Kohlenstoff 12,011 amu.
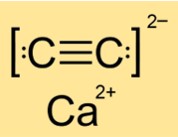
Calciumcarbid-Struktur
Die Struktur von CaC2 ist je nach Phase (I, II oder III) tetragonal, monoklin oder monoklin. Das bedeutet, dass CaC2 in unterschiedlichen Zuständen oder Zuständen unterschiedliche Formen und Anordnungen seiner Atome oder Moleküle aufweist. Die Struktur wird durch die Symmetrie und Geometrie des Stoffes bestimmt. CaC2 hat in Phase I eine tetragonale Struktur, in Phase II eine monokline Struktur und in Phase III eine weitere monokline Struktur.
Löslichkeit von Calciumcarbid
Die Löslichkeit von CaC2 beruht auf einer schnellen Hydrolyse in Wasser. Das bedeutet, dass CaC2 schnell mit Wasser reagiert und als Produkte Acetylengas und Calciumhydroxid bildet. Die Löslichkeit wird anhand der Stoffmenge gemessen, die sich in einem bestimmten Lösungsmittel bei einer bestimmten Temperatur und einem bestimmten Druck lösen kann. Die Löslichkeit hängt von der Art und Polarität der Substanz und des Lösungsmittels sowie von anderen Faktoren wie pH-Wert und Salzgehalt ab.
| Aussehen | Weißes Pulver mit grau/schwarzen Kristallen oder farbloser kristalliner Feststoff 3 |
| Spezifische Dichte | 2.22 |
| Farbe | Farblos (rein) oder grau/braun (technische Qualität) |
| Geruch | Geruchlos (rein) oder Knoblauchartig (technische Qualität) |
| Molmasse | 64.099 g/Mol |
| Dichte | 2,22 g/cm3 |
| Fusionspunkt | 2160°C |
| Siedepunkt | 2300°C |
| Blitzpunkt | 305°C (Acetylen) |
| Löslichkeit in Wasser | Schnelle Hydrolyse |
| Löslichkeit | Unlöslich in Ethanol und Ether |
| Dampfdruck | Unerheblich |
| Wasserdampfdichte | 2,21 (Acetylen) |
| pKa | Unzutreffend |
| pH-Wert | Unzutreffend |
Sicherheit und Gefahren von Calciumcarbid
CaC2 ist eine brennbare und gefährliche Chemikalie. Bei Kontakt mit Wasser oder Feuchtigkeit besteht Brand- und Explosionsgefahr. Es setzt Acetylengas frei, das ebenfalls brennbar und explosiv ist. CaC2 kann auch Ihrer Gesundheit schaden. Dies kann zu Reizungen der Haut, Augen und Lunge führen. Dies kann zu Hautausschlag, Augenschäden, Husten und Atemnot führen. Wenn Sie große Mengen einatmen, kann es auch zu Flüssigkeitsansammlungen in Ihrer Lunge kommen. Sie sollten den Kontakt mit CaC2 vermeiden und beim Umgang damit Schutzausrüstung tragen. Sie sollten es außerdem in einem trockenen, geschlossenen Behälter aufbewahren, entfernt von jeglichen Zündquellen.
| Gefahrensymbole | F (leicht entzündlich), C (ätzend), W (reagiert mit Wasser) |
| Sicherheitsbeschreibung | S2 (außerhalb der Reichweite von Kindern aufbewahren), S7/8 (Behälter dicht verschlossen und trocken halten), S16 (von Zündquellen fernhalten), S26 (bei Augenkontakt sofort mit viel Wasser spülen und einen Arzt aufsuchen Beratung), S36/37/39 (tragen Sie geeignete Schutzkleidung, Handschuhe und Augen-/Gesichtsschutz), S43 (im Brandfall trockenen Sand oder trockenes chemisches Pulver verwenden), S45 (im Falle eines Unfalls oder Unwohlseins suchen Sie einen Arzt auf (sofort ärztlichen Rat einholen) |
| UN-Identifikationsnummern | UN 1402 |
| HS-Code | 28491000 |
| Gefahrenklasse | 4.3 |
| Verpackungsgruppe | ICH |
| Toxizität | Oral LD50 Ratte: 80 mg/kg, LC50 Inhalation Ratte: 1000 ppm/4h |
Methoden zur Calciumcarbid-Synthese
Es gibt verschiedene Methoden zur Synthese von CaC2 aus Calcium- und Kohlenoxidquellen.
Eine der gebräuchlichsten Methoden ist die Elektrolichtbogenofenmethode. Bei diesem Verfahren erhitzt ein Lichtbogen ein Gemisch aus Kalk und Koks auf etwa 2.200 °C. Die Reaktion ist endotherm und erzeugt geschmolzenes CaC2 und Kohlenmonoxid. Nach dem Schmelzen kühlt das CaC2 ab und wird je nach Verwendungszweck in Stücke oder Pulver gemahlen. Diese Methode ist mit einem hohen Energieverbrauch und hohen Ausrüstungskosten verbunden.
Eine andere Methode ist die Festkörpermethode. Um diese Methode durchzuführen, erhitzen Sie eine Mischung aus Kalziumoxid und Biokohle oder aus Biomasse gewonnener Holzkohle in einem Ofen auf etwa 1.750 °C. Die Reaktion verläuft fest-fest und erzeugt festes CaC2 und Kohlenmonoxid. Sie können den CaC2-Feststoff direkt verwenden oder weiterverarbeiten. Diese Methode hat einen geringeren Energieverbrauch und geringere Ausrüstungskosten als die Elektrolichtbogenofenmethode.
Eine dritte Methode ist die Methode zur Substitution der Kohlekoksstromqualität. Zur Durchführung des Prozesses werden minderwertige Kohle und Kalk gemischt, Pellets geformt und anschließend in einem Ofen bei 1000 °C pyrolysiert. Das erzeugte Gas erzeugt Strom und die heißen Pellets werden bei 2000 °C in einen CaC2-Ofen überführt. Die Reaktion verläuft fest-fest und erzeugt geschmolzenes CaC2 und Kohlenmonoxid. Nach dem Abkühlen wird das geschmolzene CaC2 zu Klumpen oder Pulver gemahlen. Diese Methode weist eine höhere Energieeffizienz und Ressourcennutzung auf als die Elektrolichtbogenofenmethode.
Verwendung von Calciumcarbid
- Wenn CaC2 mit Wasser reagiert, entstehen Acetylengas und Calciumhydroxid. Acetylengas ist ein wichtiges Zwischenprodukt für die Synthese vieler organischer Chemikalien und Polymere wie Polyvinylchlorid, Vinylacetat, 1,4-Butandiol usw. Calciumhydroxid ist eine vielseitige Verbindung mit vielfältigen Einsatzmöglichkeiten.
- Zur Herstellung von Kalkstickstoff reagiert der Mensch bei hohen Temperaturen mit Stickstoff. Calciumcyanamid wirkt als Stickstoffdünger, Herbizid und Entlaubungsmittel.
- Um den Schwefelgehalt von Eisen, Gusseisen, Gusseisen und Stahl zu reduzieren, wird CaC2 verwendet. Diese chemische Verbindung reagiert mit Schwefel unter Bildung von Calciumsulfid und entschwefelt das Metall effektiv. Dieser Prozess verbessert die Qualität und Duktilität von Stahlprodukten.
- Karbidlampen erzeugen mithilfe von CaC2 Acetylengas, das bei der Verbrennung Licht erzeugt. Diese Lampen waren in der Bergbau-, Höhlen-, Fahrrad- und Automobilindustrie beliebt, bevor elektrische Lampen üblich wurden.
- Menschen verwenden CaC2 als Reifungsmittel in Früchten wie Bananen, Mangos und Papayas. Es setzt Ethylengas frei, das den Reifungsprozess beschleunigt und die Farbe und Süße der Früchte verstärkt. Viele Länder halten die Verwendung von CaC2-Rückständen zur Reifung von Früchten aufgrund der damit verbundenen Gesundheitsrisiken für illegal und schädlich.
- Menschen verwenden CaC2 in Bambuskanonen und Urknallkanonen, um laute Geräusche zu erzeugen. Wenn es mit Wasser vermischt wird, entsteht Acetylengas, das sich entzündet und für ein lustiges und festliches Erlebnis für alle sorgt.
- Wird auch als Desoxidationsmittel bei der Stahlherstellung verwendet. Es entfernt Sauerstoff aus geschmolzenem Stahl und verhindert die Bildung von Oxiden, die die Qualität von Stahlprodukten beeinträchtigen können.
Fragen:
F: Wo kann man Calciumcarbid vor Ort kaufen?
A: Möglicherweise können Sie in einigen Baumärkten oder Schweißfachgeschäften in Ihrer Nähe kleine Mengen CaC2 finden. Wenn Sie jedoch große Mengen CaC2 benötigen, ist es möglicherweise am besten, es direkt vom Hersteller zu importieren. Einige Anbieter können Sie online kontaktieren.
F: Wie entferne ich Kalziumkarbid?
A: CaC2 ist ein gefährlicher Abfall und muss ordnungsgemäß entsorgt werden. Werfen Sie es nicht in den Müll oder in den Abfluss, da es mit Wasser reagieren und Acetylengas erzeugen kann, das brennbar und explosiv ist. Sie sollten sich an Ihre örtliche Behörde für gefährliche Abfälle oder ein zugelassenes Abfallentsorgungsunternehmen wenden, um Ratschläge zur sicheren Entsorgung von CaC2 zu erhalten. Möglicherweise muss es in einem gut belüfteten Bereich mit Wasser neutralisiert und dann für den Transport in einen verschlossenen Behälter verpackt werden.
F: Was entsteht, wenn Calciumcarbid mit schwerem Wasser reagiert?
A: Schweres Wasser ist Wasser, das Deuterium anstelle von Wasserstoff enthält. Deuterium ist ein Wasserstoffisotop, dessen Kern ein Proton und ein Neutron enthält. Wenn CaC2 mit schwerem Wasser reagiert, bildet es Calciumhydroxid und deuteriertes Acetylen. Deuteriertes Acetylen ist Acetylen, das Deuterium anstelle von Wasserstoff enthält. Die chemische Gleichung für diese Reaktion lautet:
CaC2 + 2D2O -> Ca(OD)2 + C2D2
F: Ist Calciumcarbid gefährlich?
A: Ja, CaC2 ist gefährlich und sollte mit Vorsicht gehandhabt werden. Bei Kontakt mit Wasser oder Feuchtigkeit kann es zu Brand- und Explosionsgefahr kommen, da Acetylengas freigesetzt wird, das ebenfalls brennbar und explosiv ist. Es kann auch Ihrer Gesundheit schaden, da es Ihre Haut, Augen und Lunge reizen kann. CaC2 kann Hautausschläge, Augenschäden, Husten und Atemnot verursachen. Wenn Sie große Mengen einatmen, kann es auch zu Flüssigkeitsansammlungen in Ihrer Lunge kommen. Sie sollten den Kontakt mit CaC2 vermeiden und beim Umgang damit Schutzausrüstung tragen. Sie sollten es außerdem in einem trockenen, geschlossenen Behälter aufbewahren, entfernt von jeglichen Zündquellen.
F: Ist Calciumcarbid ionisch oder kovalent?
A: CaC2 ist eine ionische Verbindung. Es besteht aus Calciumionen (Ca2+) und Karbidionen (C22-). Ionische Verbindungen entstehen, wenn Metallatome Elektronen verlieren und Nichtmetallatome Elektronen gewinnen, um stabile elektronische Konfigurationen zu erreichen. Die entstehenden Ionen werden durch elektrostatische Anziehungskräfte zusammengehalten. CaC2 verfügt über starke Ionenbindungen, deren Spaltung viel Energie erfordert.
F: Wie wird Calciumcarbid hergestellt?
A: CaC2 wird durch Erhitzen einer Mischung aus Kalk (Kalziumoxid) und Koks (Kohlenstoff) auf etwa 2200 °C in einem Elektrolichtbogenofen gewonnen. Die Reaktion ist endotherm und erzeugt geschmolzenes CaC2 und Kohlenmonoxid. Das geschmolzene CaC2 wird dann abgekühlt und in Stücke oder Pulver gemahlen. Diese Methode ist mit einem hohen Energieverbrauch und hohen Ausrüstungskosten verbunden. Es gibt auch andere Methoden, die unterschiedliche Kohlenstoffquellen nutzen, wie zum Beispiel Pflanzenkohle oder niedrigkohlehaltige Kohle, und andere Heizmethoden, wie zum Beispiel Festkörpererwärmung oder Induktionserwärmung. Diese Methoden können einen geringeren Energieverbrauch und geringere Ausrüstungskosten haben als die Elektrolichtbogenofenmethode.
F: Kann ich Calciumcarbonat in Calciumcarbid umwandeln?
A: Nein, Sie können Calciumcarbonat nicht direkt in CaC2 umwandeln. Calciumcarbonat ist eine stabile Verbindung, die bei hohen Temperaturen nicht mit Kohlenstoff reagiert. Calciumcarbonat muss zunächst durch starkes Erhitzen unter Luftabschluss (Kalzinierung) in Calciumoxid umgewandelt werden. Dann kann man Calciumoxid mit Kohlenstoff bei hohen Temperaturen reagieren lassen, um CaC2 zu erzeugen (Aufkohlung). Die allgemeine chemische Gleichung für diesen Prozess lautet:
CaCO3 -> CaO + CO2
CaO + 3C -> CaC2 + CO
F: Was trifft auf die folgende Reaktion zu? Ca(s) + 2C(s) -> CaC2(s) + 62,8 kJ
A: Für die Reaktion gelten folgende Aussagen:
- Es handelt sich um eine synthetische Reaktion, bei der sich zwei oder mehr Elemente zu einer Verbindung verbinden.
- Dabei handelt es sich um eine exotherme Reaktion, bei der Wärme an die Umgebung abgegeben wird.
- Dabei handelt es sich um eine Redoxreaktion, bei der Kalzium oxidiert und Kohlenstoff reduziert wird.
- Dies ist die umgekehrte Reaktion der Bildung von CaC2 aus Calciumoxid und Kohlenstoff.
F: Was ist die Standardbildungswärme von cac2(s)?
A: Die Standardbildungswärme von cac2(s) ist die Enthalpieänderung, wenn ein Mol CaC2 aus seinen Elementen in ihren Standardzuständen bei 25 °C und 1 atm gebildet wird. Sie kann aus den gegebenen thermochemischen Gleichungen mit dem Hessschen Gesetz berechnet werden. Die Gesamtgleichung für die CaC2-Bildung lautet:
Ca(s) + 2C(s) -> CaC2(s)
Mit dem Hessschen Gesetz können wir schreiben:
ΔHf°(CaC2) = ΔH°(Ca + 2C -> CaC2)
= ΔH°(Ca + 2H2O -> Ca(OH)2 + H2) + ΔH°(Ca(OH)2 -> CaO + H2O) + ΔH°(CaO + 3C -> CaC2 + CO) + ΔH°(CO -> C + O2) + ΔH°(H2 + O2 -> H2O)
= -414,79 kJ + 65,19 kJ + 462,30 kJ – 221,00 kJ – 571,80 kJ = -680,10 kJ
Daher beträgt die Standardbildungswärme von cac2(s) -680,10 kJ/mol.
F: Wie viele Gramm cac2 wären nötig, um 0,35 Mol hcch(g) zu erzeugen?
A: Um diese Frage zu beantworten, müssen wir die ausgeglichene Gleichung für die Reaktion zwischen CaC2 und Wasser verwenden:
CaC2(s) + 2H2O(l) -> C2H2(g) + Ca(OH)2(aq)
Aus dieser Gleichung können wir ersehen, dass ein Mol Cac2 ein Mol Hcch (auch Acetylen genannt) produziert. Um 0,35 Mol hcch zu erzeugen, benötigen wir daher 0,35 Mol cac2. Zur Umrechnung von Mol in Gramm müssen wir die Molmasse von cac2 verwenden, die 64,099 g/mol beträgt. Durch Multiplikation der Mol mit der Molmasse erhalten wir:
0,35 Mol x 64,099 g/mol = 22,435 g
Daher benötigen wir 22,435 Gramm Cac2, um 0,35 Mol Hcch zu erzeugen.
F: Wie viele Mol cac2 werden benötigt, um mit 49,0 g Wasser vollständig zu reagieren?
A: Um diese Frage zu beantworten, müssen wir die ausgeglichene Gleichung für die Reaktion zwischen Calciumcarbid und Wasser verwenden:
CaC2(s) + 2H2O(l) -> C2H2(g) + Ca(OH)2(aq)
Aus dieser Gleichung können wir ersehen, dass ein Mol Cac2 mit zwei Mol H2O reagiert. Um die benötigten Mole an cac2 zu ermitteln, müssen wir daher die Mole an Wasser durch zwei dividieren. Um Gramm in Mol umzurechnen, müssen wir die Molmasse von Wasser verwenden, die 18,015 g/mol beträgt. Indem wir die Gramm durch die Molmasse dividieren, erhalten wir:
49,0 g / 18,015 g/mol = 2,72 Mol
Wenn man dies durch zwei dividiert, erhält man:
2,72 Mol / 2 = 1,36 Mol
Daher benötigen wir 1,36 Mol Cac2, um mit 49,0 g Wasser vollständig zu reagieren.
F: Was sind die Produkte der Reaktion zwischen Calciumcarbid und Wasser?
A: Die Produkte der Reaktion zwischen CaC2 und Wasser sind Acetylengas und Calciumhydroxidlösung.
