Bariumnitrat (Ba(NO3)2) ist ein weißer Feststoff. Es löst sich in Wasser und bildet Barium- und Nitrationen. Es kann explodieren, wenn es erhitzt oder mit Kraftstoffen vermischt wird.
| Name der IUPAC | Bariumdinitrat |
| Molekularformel | Ba(NO3)2 |
| CAS-Nummer | 10022-31-8 |
| Synonyme | Bariumnitrat, Bariumdinitrat, Bariumdinitrat, CQ9625000, (Nitrooxy)barionitrat |
| InChI | InChI=1S/Ba.2NO3/c;2 2-1(3)4/q+2;2 -1 |
Eigenschaften von Bariumnitrat
Bariumnitrat-Formel
Die Summenformel für Bariumnitrat lautet Ba(NO3)2. Es zeigt, dass ein Bariumnitratmolekül aus einem Bariumatom und zwei Nitratmolekülen besteht. Das Nitration hat eine Ladung von -1 und das Bariumion eine Ladung von +2, sodass sie sich im Verhältnis 1:2 zu einer neutralen Verbindung verbinden.
Molmasse von Bariumnitrat
Die Molmasse von Ba(NO3)2 beträgt 261,337 g/mol. Es handelt sich um die Masse eines Mols Ba(NO3)2-Moleküle. Um es zu berechnen, müssen Sie die Atommassen aller Atome in der Formel addieren:
Molmasse von Ba(NO3)2 = (1 x 137,327) + (2 x 14,007) + (6 x 15,999) = 261,337 g/mol
Siedepunkt von Bariumnitrat
Der Siedepunkt von Ba(NO3)2 liegt bei 83°C. Dies ist die Temperatur, bei der Ba(NO3)2 vom flüssigen in den gasförmigen Zustand übergeht. Allerdings zersetzt sich Ba(NO3)2, bevor es seinen Siedepunkt erreicht, so dass es nicht möglich ist, es zu kochen, ohne es in andere Stoffe zu zerlegen.
Bariumnitrat Schmelzpunkt
Der Schmelzpunkt von Ba(NO3)2 beträgt 592°C. Dies ist die Temperatur, bei der Ba(NO3)2 vom festen in den flüssigen Zustand übergeht. Ba(NO3)2 ist bei Raumtemperatur und -druck ein weißer kristalliner Feststoff, der jedoch schmilzt, wenn es über seinen Schmelzpunkt erhitzt wird.
Dichte von Bariumnitrat g/ml
Die Dichte von Ba(NO3)2 beträgt 3,23 g/ml. Dies ist die Masse pro Volumeneinheit von Ba(NO3)2. Um es zu berechnen, müssen Sie die Masse einer Ba(NO3)2-Probe durch ihr Volumen dividieren:
Dichte von Ba(NO3)2 = Masse / Volumen
Wenn wir beispielsweise eine 10-g-Probe Ba(NO3)2 haben und ihr Volumen 3,1 ml beträgt, dann ist ihre Dichte:
Dichte von Ba(NO3)2 = 10 / 3,1 = 3,23 g/ml
Molekulargewicht von Bariumnitrat
Das Molekulargewicht von Ba(NO3)2 entspricht seiner Molmasse, die 261,337 g/mol beträgt. Es handelt sich um die Masse eines Mols Ba(NO3)2-Moleküle. Manchmal wird der Begriff „Molekulargewicht“ synonym mit „Molmasse“ verwendet, sie sind jedoch nicht genau dasselbe. Das Molekulargewicht bezieht sich auf die durchschnittliche Masse eines Moleküls einer Substanz, während sich die Molmasse auf die Masse eines Mols einer Substanz bezieht.
Struktur von Bariumnitrat
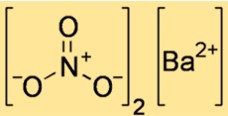
Die Struktur von Ba(NO3)2 zeigt, wie Atome und Ionen im Raum angeordnet sind. Ba(NO3)2 ist eine ionische Verbindung, das heißt, sie besteht aus positiv geladenen Bariumionen und negativ geladenen Nitrationen, die durch elektrostatische Kräfte zusammengehalten werden. Die Struktur von Ba(NO3)2 kann durch eine Elementarzelle dargestellt werden, die kleinste wiederkehrende Einheit, die die Anordnung von Ionen in einem Kristallgitter zeigt.
Eine Elementarzelle aus Ba(NO3)2 hat eine kubische Form mit einem Bariumion an jeder Ecke und einem Nitration in der Mitte jeder Fläche. Die Koordinationszahl jedes Ions beträgt sechs, was bedeutet, dass jedes Ion von sechs entgegengesetzt geladenen Ionen umgeben ist. Die Länge jeder Kante der Elementarzelle beträgt 0,65 nm.
Löslichkeit von Bariumnitrat
Die Löslichkeit von Ba(NO3)2 ist die Menge an Ba(NO3)2, die sich in einer bestimmten Menge Lösungsmittel, normalerweise Wasser, lösen kann. Die Löslichkeit hängt von mehreren Faktoren ab, beispielsweise der Temperatur, dem Druck und dem Vorhandensein anderer Substanzen in der Lösung.
Bei 20 °C und Atmosphärendruck beträgt die Löslichkeit von Ba(NO3)2 in Wasser etwa 34 g pro 100 ml. Das bedeutet, dass sich unter diesen Bedingungen 34 g Ba(NO3)2 in 100 ml Wasser lösen können. Die Löslichkeit nimmt mit steigender Temperatur zu und mit steigendem Druck ab.
Ba(NO3)2 ist auch in anderen Lösungsmitteln wie Ethanol, Aceton und Methanol löslich, jedoch weniger löslich als in Wasser.
| Aussehen | Weißer Feststoff |
| Spezifische Dichte | 3.23 |
| Farbe | Farblos, silber oder grau |
| Geruch | Geruchlos |
| Molmasse | 261.337 g/Mol |
| Dichte | 3,23 g/ml |
| Fusionspunkt | 592°C |
| Siedepunkt | 83°C |
| Blitzpunkt | Nicht brennbar |
| Löslichkeit in Wasser | 34 g pro 100 ml bei 20°C |
| Löslichkeit | Löslich in Ethanol, Aceton und Methanol; unlöslich in Ether und Chloroform |
| Dampfdruck | Unerheblich |
| Wasserdampfdichte | Unzutreffend |
| pKa | Unzutreffend |
| pH-Wert | Nicht verfügbar |
Sicherheit und Gefahren von Bariumnitrat
Ba(NO3)2 ist eine giftige und oxidierende Substanz. Es kann Ihnen schaden, wenn Sie es verschlucken oder einatmen. Dies kann zu Reizungen der Augen, der Haut und der Atemwege führen. Ba(NO3)2 kann auch Muskelkrämpfe, Herzprobleme und den Tod verursachen. Sie sollten den Kontakt mit Ba(NO3)2 vermeiden und beim Umgang damit Schutzausrüstung tragen. Halten Sie es außerdem von Hitze, Funken, Flammen und brennbaren Materialien fern. Wenn Sie Ba(NO3)2 ausgesetzt sind, sollten Sie Ihre Augen und Haut mit Wasser spülen und einen Arzt aufsuchen. Sie können auch Sulfatsalze einnehmen, um die Toxizität von Barium zu verringern.
| Gefahrensymbole | O (Oxidationsmittel), Xn (schädlich) |
| Sicherheitsbeschreibung | S13: Von Nahrungsmitteln und Getränken fernhalten, auch von solchen für Tiere. S17: Von brennbaren Materialien fernhalten. S22: Staub nicht einatmen. S26: Bei Augenkontakt sofort mit viel Wasser ausspülen und einen Arzt aufsuchen. S36/37/39: Geeignete Schutzkleidung, Handschuhe und Augen-/Gesichtsschutz tragen. |
| UN-Identifikationsnummern | UN1446 |
| HS-Code | 2834 29 10 |
| Gefahrenklasse | 5.1 (Oxidierende Materialien) |
| Verpackungsgruppe | III |
| Toxizität | LD50 (oral, Ratte) = 355 mg/kg; LC50 (Inhalation, Ratte) = 0,15 mg/L/4h |
Methoden zur Synthese von Bariumnitrat
Zur Herstellung von Ba(NO3)2, einem weißen Feststoff, können verschiedene Methoden eingesetzt werden.
Eine Methode besteht darin, Bariumcarbonat mit Salpetersäure umzusetzen. Dabei entstehen Ba(NO3)2 und Kohlendioxid. Filtern Sie die Ba(NO3)2-Lösung, um etwaige Eisenverunreinigungen zu entfernen, und verdampfen Sie sie dann, um feste Kristalle zu erhalten.
Eine andere Methode ist die Reaktion von Bariumsulfid mit Salpetersäure . Dabei entstehen Ba(NO3)2 und Schwefelwasserstoff. Um die Ba(NO3)2-Lösung zu reinigen und zu kristallisieren, folgen wir dem gleichen Verfahren wie zuvor.
Eine dritte Methode besteht darin, Bariummetall oder Bariumoxid in Salpetersäure aufzulösen. Dabei entstehen Ba(NO3)2 und Wasserstoff bzw. Wasser. Die Ba(NO3)2 enthaltende Lösung wird dann konzentriert und kristallisiert.
Eine vierte Methode ist die Synthese geschmolzener Salze. Dabei wird eine Mischung aus Ba(NO3)2 und einem anorganischen Blähmittel wie Ammoniumchlorid, Natriumbicarbonat oder Natriumnitrit erhitzt. Das blasenbildende Mittel zersetzt sich und erzeugt Poren in den Ba(NO3)2-Kristallen. Dies macht sie als pyrotechnische Oxidationsmittel zuverlässiger.
Hier sind einige der Methoden zur Synthese von Ba(NO3)2. Sie alle nutzen Salpetersäure als gemeinsamen Reaktanten und produzieren als Produkt Ba(NO3)2.
Verwendung von Bariumnitrat
Einige der Verwendungszwecke von Ba(NO3)2 sind:
- Bariumoxidverbindungen – werden bei der Herstellung von Materialien verwendet, die Bariumoxid enthalten, wie z. B. Keramik, Glas und Kathodenstrahlröhren.
- Grüne Flamme – Wird in grünen Ampeln und Feuerwerkskörpern verwendet, da sie aufgrund der Emission von Bariumionen mit einer grünen Flamme brennt.
- Rodentizid – Wird als Rodentizid zur Tötung von Ratten und Mäusen verwendet, da es für diese giftig ist.
- Oxidationsmittel – Wird in Zündern und Sprengstoffen verwendet und ist ein starkes Oxidationsmittel, das die Verbrennung anderer Substanzen fördern kann.
- Zündhütchen – Wird in Zündhütchen und Leuchtspurgeschossen verwendet, da es für die Zündung und Sichtbarkeit der Munition sorgt.
- Pigment – Wird bei der Herstellung von Farben und Pigmenten verwendet, da es ihnen eine weiße oder grüne Farbe verleihen kann.
- Oxidationsmittel – Wird als Oxidationsmittel bei verschiedenen chemischen Reaktionen verwendet, beispielsweise bei der Synthese von Bariumperoxid und Bariumhydroxid.
- Sprengstoffe – werden bei der Herstellung von Sprengstoffen wie Baratol verwendet, einer Mischung aus Ba(NO3)2, TNT und Bindemittel.
Fragen:
F: Ist Bariumnitrat löslich?
A: Ba(NO3)2 ist in Wasser und einigen anderen Lösungsmitteln wie Ethanol, Aceton und Methanol löslich.
F: Ist Bariumnitrat für Beton nützlich?
A: Ba(NO3)2 ist für Beton nicht geeignet, da es zu Korrosion der Stahlbewehrung und Rissbildung im Beton führen kann.
F: Wird sich ein Niederschlag bilden, wenn Lösungen von Kaliumsulfat und Bariumnitrat kombiniert werden?
A: Ja, es bildet sich ein Niederschlag aus Bariumsulfat (BaSO4), wenn Lösungen aus Kaliumsulfat (K2SO4) und Bariumnitrat (Ba(NO3)2) kombiniert werden.
F: Bariumnitrat hat die Formel Ba(NO3)2. Welche Aussage zu Bariumnitrat trifft zu?
A: Eine mögliche Aussage ist: Ba(NO3)2 ist eine ionische Verbindung bestehend aus einem Bariumion und zwei Nitrationen.
F: Ist Bariumnitrat flüchtig?
A: Nein, Ba(NO3)2 ist nicht flüchtig, da es einen hohen Schmelzpunkt hat und sich vor dem Sieden zersetzt.
F: Ist Bariumnitrat neutral?
A: Nein, Ba(NO3)2 ist nicht neutral, da es ein saures Salz ist, das den pH-Wert einer Lösung senken kann.
F: Was entsteht bei der Austauschreaktion von Ba(NO3)2 und Na2SO4?
A: NaNO3 und BaSO4 entstehen bei der Austauschreaktion von Ba(NO3)2 und Na2SO4.
F: Ist Ba(NO3)2 wasserlöslich?
A: Ja, Ba(NO3)2 ist in Wasser löslich, da es sich unter Bildung von Bariumionen und Nitrationen auflöst.
F: Wie lautet die Nettoionengleichung für die Reaktion von MgSO4 mit Ba(NO3)2?
A: Die Nettoionengleichung für die Reaktion von MgSO4 mit Ba(NO3)2 lautet:
Ba2+ + SO42- → BaSO4
F: Wie viele Mol sind in 432 g Ba(NO3)2 enthalten?
A: Die Molzahl in 432 g Ba(NO3)2 beträgt:
n = m/M, n = 432/261.337, n = 1.653 Mol
F: Ist Ba(NO3)2 löslich?
A: Ja, Ba(NO3)2 ist löslich, weil es sich unter Bildung von Bariumionen und Nitrationen auflöst.
