Ammoniumnitrat (NH4NO3) ist eine chemische Verbindung. Es kann als Dünger oder als Sprengstoff verwendet werden. Es ist gut wasserlöslich und hygroskopisch.
| Name der IUPAC | Ammoniumnitrat |
| Molekularformel | NH4NO3 |
| CAS-Nummer | 6484-52-2 |
| Synonyme | Ammoniumsalz der Salpetersäure, Ammoniumnitrat (AN), Ammonium nitratum, Nitrame, Nitramon |
| InChI | InChI=1S/NO3.H3N/c2-1(3)4;/h;1H3/q-1;/p+1 |
Eigenschaften von Ammoniumnitrat
Ammoniumnitrat-Formel
Ammoniumnitrat ist eine chemische Verbindung mit der Formel NH4NO3. Es besteht aus zwei Ionen: Ammonium (NH4+) und Nitrat (NO3-), die durch eine Ionenbindung 2 zusammengehalten werden. Es ist ein weißes, kristallines Pulver, das in Wasser leicht löslich ist.
Molmasse von Ammoniumnitrat
Die Molmasse von NH4NO3 beträgt 80,043 g/mol. Sie kann durch Addition der Molmassen seiner Bestandteile Stickstoff, Wasserstoff und Sauerstoff berechnet werden. Die Molmasse von Stickstoff beträgt 14,0067 g/mol, die Molmasse von Wasserstoff beträgt 1,00784 g/mol und die Molmasse von Sauerstoff beträgt 15,9999 g/mol.
Die Molmasse von NH4NO3 = 2 x Molmasse von Stickstoff + 4 x Molmasse von Wasserstoff + 3 x Molmasse von Sauerstoff
Die Molmasse von NH4NO3 = 28,0134 g/mol + 4,03136 g/mol + 47,9997 g/mol
Die Molmasse von NH4NO3 = 80,043 g/mol
Siedepunkt von Ammoniumnitrat
NH4NO3 hat keinen definierten Siedepunkt. Bei hohen Temperaturen zersetzt es sich und setzt Gase wie Stickstoff, Sauerstoff und Wasserdampf frei. Die Zersetzungstemperatur von NH4NO3 variiert je nach Reinheit, Feuchtigkeit und dem Vorhandensein von Verunreinigungen oder Zusatzstoffen. Die Zersetzungstemperatur von reinem NH4NO3 beträgt etwa 210 °C oder 483 K.
Schmelzpunkt von Ammoniumnitrat
Der Schmelzpunkt von NH4NO3 liegt bei 169,6 °C bzw. 442,8 K. Bei dieser Temperatur vollzieht es einen Phasenübergang von einer rhomboedrischen Kristallstruktur zu einer kubischen Kristallstruktur. Es kann auch ein eutektisches Gemisch mit Wasser bilden, das einen niedrigeren Schmelzpunkt von etwa -16 °C oder 257 K hat.
Dichte von Ammoniumnitrat g/ml
Die Dichte von NH4NO3 beträgt 1,725 g/ml oder 1725 kg/m3 bei Umgebungstemperatur und -druck. Es ist dichter als Wasser, das unter gleichen Bedingungen eine Dichte von etwa 1 g/ml oder 1000 kg/m3 hat. Die Dichte von NH4NO3 nimmt mit zunehmender Temperatur aufgrund der Wärmeausdehnung ab.
Molekulargewicht von Ammoniumnitrat
Das Molekulargewicht von NH4NO3 entspricht seiner Molmasse, die 80,043 g/mol beträgt. Das Molekulargewicht ist die Masse eines Mols oder 6,022 x 10^(23) Molekülen NH4NO3. Das Molekulargewicht kann auch in Atommasseneinheiten (amu) ausgedrückt werden, die als ein Zwölftel der Masse eines Kohlenstoff-12-Atoms definiert sind.
Das Molekulargewicht von NH4NO3 in amu beträgt 80,043 x (1/12) x (10^(23)) amu
Das Molekulargewicht von NH4NO3 in amu beträgt ungefähr 6,669 x 10^(23) amu
Struktur von Ammoniumnitrat
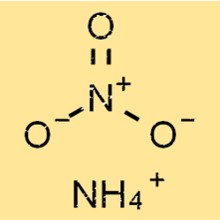
NH4NO3 hat eine einfache Ionenstruktur, bestehend aus positiv geladenen Ammoniumionen und negativ geladenen Nitrationen. Das Ammoniumion hat eine tetraedrische Form mit vier Wasserstoffatomen, die durch kovalente Bindungen an ein zentrales Stickstoffatom gebunden sind.
NH4+
H
|
HNH
|
H
Das Nitration hat eine trigonal-planare Form mit drei Sauerstoffatomen, die durch kovalente Bindungen an ein zentrales Stickstoffatom gebunden sind, von denen eine eine Doppelbindung ist.
Nr. 3-
Oh
||
Oh
Löslichkeit von Ammoniumnitrat
Die Löslichkeit von NH4NO3 bezieht sich auf die Menge dieser Verbindung, die sich in Wasser oder anderen Lösungsmitteln löst. NH4NO3 ist in Wasser sehr gut löslich und seine Löslichkeit nimmt mit der Temperatur zu. Beispielsweise können sich bei 20 °C 150 g NH4NO3 in 100 ml Wasser lösen, bei 100 °C können sich jedoch 1024 g in der gleichen Menge Wasser lösen. NH4NO3 löst sich auch in Methanol, Ethanol und Aceton, jedoch nicht in Diethylether oder Chloroform. Die Löslichkeit von NH4NO3 hängt von der Anwesenheit anderer Stoffe wie Säuren, Basen, Salze oder organische Verbindungen ab. Einige dieser Stoffe können die Stabilität von NH4NO3 beeinträchtigen und zu dessen Zersetzung oder Explosion führen.
| Aussehen | Weißer kristalliner Feststoff |
| Spezifische Dichte | 1.725 |
| Farbe | Weiß oder Grau |
| Geruch | Geruchlos |
| Molmasse | 80,043 g/Mol |
| Dichte | 1,725 g/ml oder 1725 kg/m3 |
| Fusionspunkt | 169,6°C oder 442,8K |
| Siedepunkt | Etwa. 210°C oder 483 K (zersetzt sich) |
| Blitzpunkt | Nicht brennbar |
| Löslichkeit in Wasser | Endotherm, 118 g/100 ml (0 °C), 150 g/100 ml (20 °C), 297 g/100 ml (40 °C), 410 g/100 ml (60 °C), 576 g/100 ml (80 °C), 1024 g/100 ml (100°C) |
| Löslichkeit | Löslich in Wasser, Methanol, Ethanol, Aceton; unlöslich in Diethylether, Chloroform |
| Dampfdruck | Bei Raumtemperatur vernachlässigbar |
| Wasserdampfdichte | Nicht anwendbar (fest) |
| pKa | 9,25 (für NH4+) |
| pH-Wert | 5,0–6,0 (10 % wässrige Lösung) |
Sicherheit und Gefahren von Ammoniumnitrat
Die Sicherheit und Gefahren von NH4NO3 sind für jeden wichtig, der mit dieser chemischen Verbindung umgeht oder sie lagert. NH4NO3 ist ein Oxidationsmittel, das einen Brand verstärken und Explosionen verursachen kann, wenn es mit brennbaren Materialien vermischt oder Hitze, Stößen oder Verunreinigungen ausgesetzt wird. NH4NO3 kann beim Abbau auch giftige Gase wie Stickoxide und Ammoniak freisetzen. Daher sollten Menschen beim Umgang mit NH4NO3 die folgenden Sicherheitsvorkehrungen beachten:
- Bewahren Sie es an einem kühlen, trockenen und gut belüfteten Ort auf, entfernt von Feuerquellen, organischen Substanzen, Säuren, Metallen und anderen inkompatiblen Materialien.
- Bei der Handhabung Schutzkleidung, Handschuhe, Augen- und Gesichtsschutz tragen.
- Vermeiden Sie Staubbildung und sorgen Sie beim Umfüllen für ausreichende Belüftung.
- Nach der Handhabung Hände und Gesicht gründlich waschen.
- Nehmen Sie es nicht ein oder atmen Sie es nicht ein und konsultieren Sie im Falle einer Exposition einen Arzt.
- Informieren Sie die örtlichen Notfallhelfer über das Vorhandensein von NH4NO3 in der Anlage und erstellen Sie einen Notfallplan.
| Gefahrensymbole | O (Oxidationsmittel), Xi (reizend) |
| Sicherheitsbeschreibung | S17 (von brennbaren Materialien fernhalten), S26 (bei Augenkontakt sofort mit viel Wasser ausspülen und ärztlichen Rat einholen), S36/37/39 (geeignete Schutzkleidung, Handschuhe und Augen-/Gesichtsschutz tragen), S42 (Beim Begasen/Sprühen geeignete Atemschutzausrüstung tragen) |
| UN-Identifikationsnummern | S17 (von brennbaren Materialien fernhalten), S26 (bei Augenkontakt sofort mit viel Wasser ausspülen und ärztlichen Rat einholen), S36/37/39 (geeignete Schutzkleidung, Handschuhe und Augen-/Gesichtsschutz tragen), S42 (Beim Begasen/Sprühen geeignete Atemschutzausrüstung tragen) |
| HS-Code | 3102.30 (Ammoniumnitrat, auch in wässriger Lösung) |
| Gefahrenklasse | 5.1 (Oxidationsmittel) |
| Verpackungsgruppe | III (geringe Gefahr) |
| Toxizität | LD50 (oral, Ratte) = 2.085-5.300 mg/kg |
Methoden zur Ammoniumnitrat-Synthese
Um diese chemische Verbindung herzustellen, die häufig als Düngemittel und Sprengstoff verwendet wird, nutzen Chemiker verschiedene Methoden zur Synthese von NH4NO3. Es gibt verschiedene Methoden zur Synthese von NH4NO3, die gebräuchlichsten sind jedoch:
- Das Haber-Bosch- und Ostwald-Verfahren: Bei dieser Methode werden Stickstoff- und Wasserstoffgase zu Ammoniak umgesetzt und das Ammoniak anschließend mit Luft zu Salpetersäure oxidiert. Zur Bildung von NH4NO3 neutralisieren sie Ammoniak und Salpetersäure. Diese Methode erfordert hohe Temperatur, Druck und Energie und stößt viel Kohlendioxid aus.
- Die Metathesereaktion: Bei dieser Methode wird ein lösliches Ammoniumsalz mit einem löslichen Nitratsalz zu NH4NO3 und einem weiteren Salz umgesetzt. Beispielsweise können Ammoniumsulfat und Bariumnitrat zu NH4NO3 und Bariumsulfat reagieren. Diese Methode ist einfach und erfordert keine hohe Temperatur oder hohen Druck, erzeugt jedoch ein Nebenprodukt, das möglicherweise abgetrennt oder entsorgt werden muss.
- Der Plasmaprozess: Bei dieser Methode wird mithilfe eines Plasmas bei niedriger Temperatur und niedrigem Druck Stickstoff aus der Luft im Boden fixiert und so direkt im Boden NH4NO3 gebildet. Diese Methode erfordert kein Wasserstoffgas oder Katalysatoren und stößt kein Kohlendioxid aus. Außerdem kann es den Boden mit Stickstoff anreichern und das Pflanzenwachstum verbessern.
Verwendung von Ammoniumnitrat
Hier sind einige Verwendungsmöglichkeiten von NH4NO3:
- Dünger: NH4NO3 ist eine häufige Stickstoffquelle für Pflanzen, da es etwa 33,5 % Stickstoff enthält, der vollständig für die Aufnahme durch Pflanzen verfügbar ist. Hersteller beschichten weiße oder graue Ammoniumcarbonatpellets mit Ton, um zu verhindern, dass sie zusammenbacken und Feuchtigkeit aufnehmen. Sie können es in fester Form oder in Lösung anwenden, da es sich in Wasser leicht auflöst.
- Sprengstoff: NH4NO3 ist ein Oxidationsmittel, das die Detonation anderer Sprengstoffe wie Nitroglycerin, TNT, RDX oder Aluminiumpulver verstärken kann. Ein weit verbreiteter Industriesprengstoff, der 80 % der in Nordamerika verwendeten Sprengstoffe ausmacht, enthält ANFO (NH4NO3 und Heizöl) als Hauptbestandteil. Bei der Verwendung in improvisierten Sprengkörpern ist ein starker Initiator erforderlich, um es zur Detonation zu bringen. Aber auch in industriellen Anwendungen kann es eingesetzt werden.
- Pyrotechnik: Bei Feuerwerken kann NH4NO3 verwendet werden, um verschiedene Effekte wie Rauch, Funken, Sterne und Blitze zu erzeugen. Es kann auch für kalte Kompressen verwendet werden, die beim Mischen mit Wasser eine endotherme Reaktion hervorrufen.
- Andere Verwendungen: Wird als Vorstufe von Lachgas (Lachgas), einem Anästhetikum und einem Treibmittel verwendet. Als Absorptionsmittel können Stickoxide, als Nährstoffe Hefe und Antibiotika und als Komponenten Gefriermischungen zum Einsatz kommen.
Fragen:
F: Woher kommt Ammoniumnitratdünger?
A: NH4NO3-Dünger ist ein synthetisches Produkt, das aus der Reaktion von Ammoniak und Salpetersäure entsteht. Ammoniak wird aus Erdgas oder anderen Quellen gewonnen und Salpetersäure entsteht durch Oxidation von Ammoniak mit Luft. NH4NO3-Dünger kann auch mit einem Plasmaverfahren hergestellt werden, bei dem Stickstoff aus der Luft im Boden fixiert wird.
F: Was ist Ammoniumnitrat?
A: NH4NO3 ist eine chemische Verbindung mit der Formel NH4NO3. Es ist ein weißes kristallines Salz, das aus Ammonium- und Nitrationen besteht. Es ist gut wasserlöslich und in fester Form hygroskopisch, bildet jedoch keine Hydrate.
F: Wofür wird Ammoniumnitrat verwendet?
A: NH4NO3 wird hauptsächlich für zwei Zwecke verwendet: als Düngemittel und als Sprengstoff. Als Dünger versorgt es Pflanzen mit Stickstoff, der für ihr Wachstum und ihren Stoffwechsel unerlässlich ist. Als Sprengstoff wirkt es als Oxidationsmittel, das die Detonation anderer Sprengstoffe wie ANFO (NH4NO3 und Heizöl) 1 fördert. Es kann auch für andere Zwecke verwendet werden, beispielsweise zur Herstellung von Lachgas (Lachgas), kalten Kompressen, Feuerwerkskörpern und Hefenährstoffen.
F: Wie lautet die Summenformel von Ammoniumnitrat?
A: Die Summenformel von Ammoniumnitrat lautet NH4NO3. Es hat eine Molmasse von 80.043 g/mol und enthält 35 Masse-% Stickstoff.
F: Woraus besteht Ammoniumnitratdünger?
A: NH4NO3-Dünger besteht aus NH4NO3 und manchmal anderen Zusatzstoffen wie Ton, Antibackmitteln oder Stabilisatoren. Handelsübliche Qualität enthält etwa 33,5 % Stickstoff, alles in einer für die Pflanzenaufnahme verfügbaren Form.
F: Ist Ammoniumnitrat eine Säure oder eine Base?
A: NH4NO3 ist weder eine Säure noch eine Base, sondern ein Salz. Es kann in Wasser in Ammonium- und Nitrationen zerfallen, die je nach pH-Wert der Lösung als schwache Säuren oder Basen wirken können. Das Ammoniumion hat einen pKa-Wert von 9,25, was bedeutet, dass es ein Proton abgeben und in basischen Lösungen als Säure wirken kann. Das Nitration hat keinen pKa-Wert, was bedeutet, dass es keine Protonen abgeben oder aufnehmen kann, aber es kann als Base fungieren und in sauren Lösungen mit Hydroniumionen Salpetersäure bilden.
F: Ammoniumnitrat-Explosion?
A: Eine NH4NO3-Explosion ist eine heftige chemische Reaktion, die auftritt, wenn NH4NO3 schnell zerfällt und große Mengen an Gasen wie Stickstoff, Sauerstoff und Wasserdampf freisetzt. Die Zersetzung kann durch Hitze, Schock, Reibung, Kontamination oder Einschluss ausgelöst werden. Eine NH4NO3-Explosion kann schwere Schäden an Gebäuden, Menschen und der Umwelt verursachen. Einige Beispiele für NH4NO3-Explosionen sind die Texas-City-Katastrophe von 1947, die Oppau-Explosion von 1921, die Tianjin-Explosion von 2015 und die Beirut-Explosion von 2020.
F: Wie kaufe ich Ammoniumnitrat?
A: Für den Kauf von NH4NO3 ist je nach Land oder Region, in der Sie leben, möglicherweise eine Lizenz oder Genehmigung erforderlich. Tatsächlich kann NH4NO3 zur Herstellung von Sprengstoffen oder improvisierten Sprengvorrichtungen verwendet werden, die eine Gefahr für die öffentliche Sicherheit darstellen könnten. Möglicherweise müssen Sie beim Kauf von NH4NO3 auch Ihre Identität, Adresse, Kontaktdaten und den Verwendungszweck des Produkts angeben. NH4NO3 kann von zugelassenen Lieferanten oder Händlern erworben werden, die die örtlichen Vorschriften und Standards einhalten. Sie sollten außerdem die Richtlinien zur ordnungsgemäßen Lagerung und Handhabung befolgen, um Unfälle oder Missbrauch von NH4NO3 zu vermeiden.
